研究内容
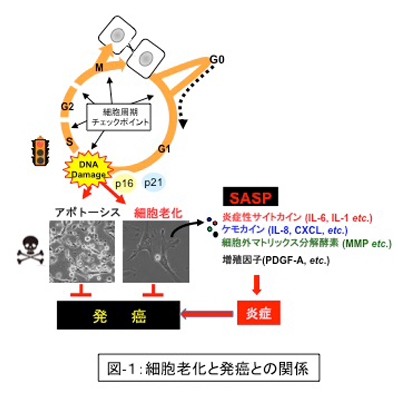
私たちの身体を構成する細胞は、異常を感知すると増殖を停止する安全装置を備えています。細胞老化はこの安全装置の一つであり、細胞の異常増殖を抑える癌抑制機構として生体の恒常性維持に寄与しています。しかしその一方で、細胞老化を起こした細胞(老化細胞)は炎症性サイトカイン、ケモカイン、増殖因子や細胞外マトリックス分解酵素など、様々な分泌因子を高発現するSASPと呼ばれる現象を起こすことで炎症を惹起し、発癌を促進する副作用があることも明らかになりつつあります。 我々は細胞老化にはSASPに限らず様々な発癌促進作用があり、老化細胞が加齢や肥満に伴い体内に蓄積することが癌を含めた様々な炎症性疾患の発症原因の一つになっていると考えています。そこで当研究室では主に細胞老化の誘導機構とその生理作用の解明を通して細胞老化の制御方法の開発を目指しています。(細胞老化研究の背景と最新の動向についてはこちらをご参照ください。)
最近の研究成果については以下を参照ください。