老化細胞のセノリティック薬耐性をミトコンドリア制御で克服 ―セノリティック薬の効果を代謝介入で大幅に強化― (原研がNature Agingに発表)
概要
本研究所分子生物学分野 脇田 将裕 助教と原 英二 教授(免疫学フロンティア研究センター(IFReC)・感染症教育研究拠点(CiDER)兼任)の研究チームは、21種類の老化細胞除去薬(セノリティック薬)の有効性を体系的に比較し、セノリティック薬に抵抗性を示す細胞亜集団を同定しました。本研究は、セノリティック抵抗性の基盤にミトコンドリア機能が関わることを明らかにするとともに、解糖系から電子伝達系 (OXPHOS) への代謝介入が マウスの生体内において老化細胞の除去効率を著しく促進することを示しています。
研究背景と結果
細胞老化(cellular senescence)は、テロメア短縮、酸化ストレス、放射線、がん遺伝子の活性化など、腫瘍化を引き起こし得るさまざまなストレスによって誘導される、安定した細胞周期停止状態です。この応答は、がん化のリスクをもつ細胞の増殖を抑制することでがん抑制機構として機能しますが、一方で老化細胞は「負の側面」も併せ持っています。老化細胞は 細胞老化随伴分泌現象(SASP) と総称される炎症性因子群を分泌し、状況に応じて組織機能障害や疾患の進展を促進します。このため、セノリティック薬による老化細胞の選択的除去は、有望な治療戦略として注目されています。
過去10年の間に20種類以上のセノリティック候補薬が報告されてきましたが、その作用機構は多岐にわたります。しかし、これらの薬剤の有効性や特異性を体系的に直接比較した研究はこれまでなく、どの薬剤が非老化細胞に無害でありつつ老化細胞を最も効果的に除去できるのかは不明でした。さらに、強力なセノリティック薬でさえ一部の老化細胞を除去できず、その耐性機構もほとんど解明されていませんでした。
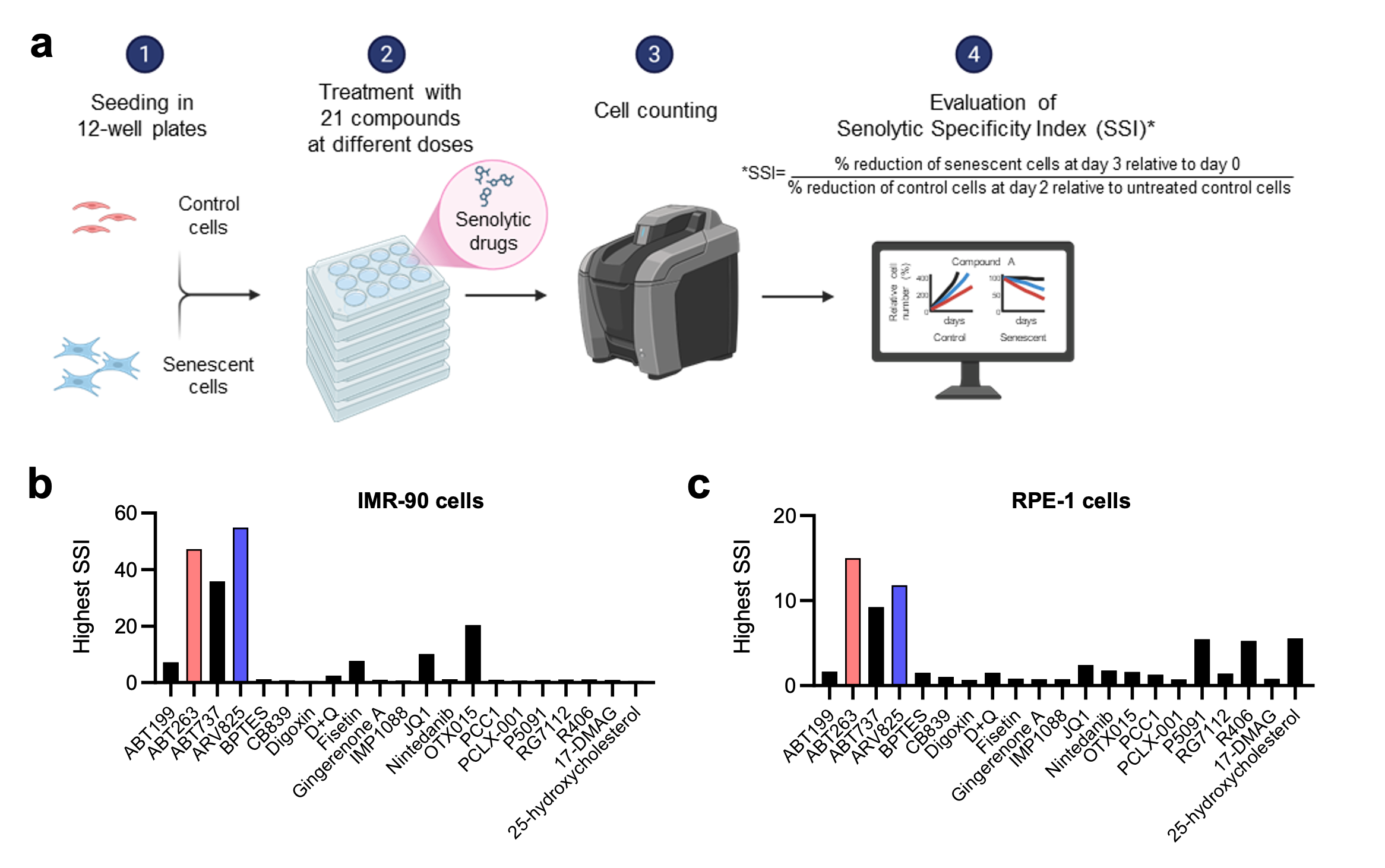
本研究において、脇田助教らは定量的な セノリティック特異性指数(Senolytic Specificity Index:SSI) を用いて21種類のセノリティック薬を体系的に比較しました。その結果、Bcl-2阻害剤 ABT263 と BET阻害剤 ARV825 が、線維芽細胞および上皮細胞モデルにおいて最も強力かつ特異性が高いなセノリティック薬であることが明らかになりました(図 1)。しかし、これらの強力なセノリティック薬を長期間投与しても、一部の老化細胞は生存し続けました。
脇田助教らは、このセノリティック薬耐性が、V-ATPase を介した損傷ミトコンドリアの除去によるミトコンドリア恒常性の維持によって引き起こされていることを突き止めました。代謝介入によって解糖系を抑えてOXPHOSへの依存度を高め、ミトコンドリアにより多くのストレスを課すと、ABT263 および ARV825 のセノリティック効果は in vitro およびマウスモデルの両方で顕著に増強されました。特に既に臨床現場で使用されている、ケトン食あるいは SGLT2阻害も同様に ABT263 および ARV825 によるセノリシス効果を増強し、腫瘍の転移や増殖を抑制しました。
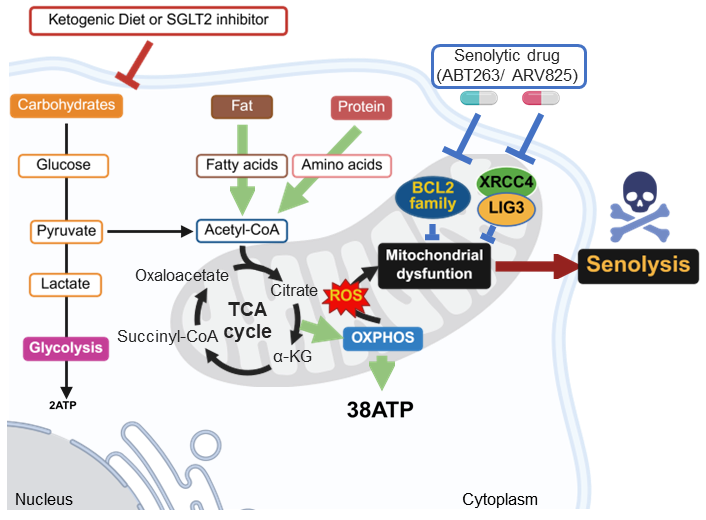
これらの結果は、ミトコンドリアの品質管理機構が ABT263 および ARV825 に対するセノリティック抵抗性を規定する主要因であることを示しており、代謝的脆弱性を標的とした効果的な併用セノセラピーの可能性を提供するものです(図 2)。
*本研究成果は英国科学誌Nature Agingに2026年1月29日にオンライン掲載されました。
タイトル: Comparative analysis of senolytic drugs reveals mitochondrial determinants of efficacy and resistance.
著者: Masahiro Wakita, Koyu Ito, Kaho Fujii, Dai Sakamoto, Takumi Mikawa, Sho Sugawara, Xiangyu Zhou, Jeong Hoon Park, Hideka Miyagawa, Daisuke Motooka, Emi Ogasawara, Naotada Ishihara, Akiko Takahashi, Hiroshi Kondoh, and Eiji Hara
関連リンク
-
図-1 |老化細胞除去薬の比較解析により、ABT263とARV825が最も強力な化合物であることが明らかになった。
a. 老化細胞除去薬の比較解析の概要。 継代数の少ないヒト皮膚線維芽細胞(IMR-90細胞)とRPE-1上皮細胞において、それぞれ継代培養(Rep-Sen細胞)または150 ng/mlドキソルビシンによる10日間処理(DXR-Sen細胞)によって細胞老化を誘導した。老化細胞と非老化細胞(対照)を、21種類の化合物で様々な濃度において3日間処理した。実験期間中、相対的な細胞数を測定した。老化細胞除去特異性指標(SSI)は以下の式で算出した:
SSI = (0日目に対する3日目の老化細胞の減少率)÷(未処理対照細胞に対する2日目の対照細胞の減少率)
※2日目の対照細胞の減少率が1%未満の場合、分母は1とした。 (BioRender.comで作成。)
b と c. 各化合物について、SSI値が最も高くなる濃度でのSSI値を示している。
-
図2 | 代謝シフトによってABT263とARV825の老化細胞除去活性を増強するメカニズムのモデル
ケトン食(糖質制限食)とSGLT2阻害薬は血糖値を低下させ、それによって解糖系を抑制し、代償的に酸化的リン酸化(OXPHOS)を亢進させる。これによりミトコンドリアの作業負荷が増大し、ミトコンドリアストレスが誘導される。その結果、ABT263やARV825のようなミトコンドリアを標的とする老化細胞除去薬に対して、ミトコンドリアがより脆弱になり、老化細胞除去薬(セノリティック薬)の効果が増強される。
補足説明:
代謝シフト: エネルギー産生方法が解糖系(糖をエネルギー源とする)から酸化的リン酸化(ミトコンドリアでの効率的なエネルギー産生)へ切り替わること
SGLT2阻害薬: 糖尿病治療薬の一種で、腎臓での糖の再吸収を抑制し血糖値を下げる
OXPHOS(酸化的リン酸化): ミトコンドリア内で行われる効率的なエネルギー産生システム
ミトコンドリアストレス: ミトコンドリアへの負荷が増大し、機能不全に陥りやすい状態
つまり、糖質制限や血糖値を低下させる薬剤によってミトコンドリアに負担をかけることで、老化細胞のミトコンドリアがより弱くなり、セノリティック薬が効きやすくなるという仕組みです。