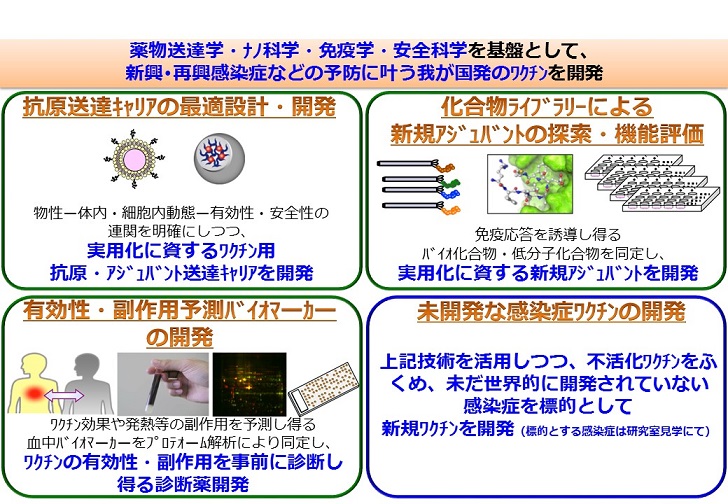
研究概要:昨今のエボラ出血熱やデング熱の猛威、近年の新型インフルエンザのパンデミックや結核等の再興からも明らかなように、病原性ウイルス・細菌による感染症は未だ、ヒトの健康維持における圧倒的脅威となっている。その点、最強で最善の予防・治療手段であるワクチンの開発が、感染症の克服に向けてのキーポイントとなっているものの、ワクチンの存在しない感染症や、ワクチンが存在しても効果が不十分なものも多数存在している。そのため、感染症に対するワクチン開発は、世界規模での、医療薬学における最重要課題といっても過言ではない。一方でこれまで、病原性を低下させた弱毒株などを用いる生ワクチンにより、多くのワクチンが開発され、感染症の克服に貢献してきた。近年ではさらに、病原体そのものではなく、病原体由来の蛋白質やペプチドを抗原として用いたワクチン開発にも期待が寄せられている。しかし現状では、➊蛋白質やペプチドを単独で投与しても、免疫誘導の場であるリンパ節や免疫細胞へほとんど移行せず、免疫応答が誘導されにくいこと<適切な抗原送達キャリアの開発が必須>、➋病原体に対する防御免疫を十分に誘導するための免疫賦活化剤(アジュバント)の開発が遅れていることが、ワクチン開発における決定的な問題となっている。さらに、子宮頸がんワクチンの副反応問題も相俟って、ワクチンの安全性への関心が高まる今日、❸今後開発されるワクチンには、これまで以上の安全・安心が求められており、「安全科学/毒性学的観点からの安全性確保」が必須となっている。以上の観点から我々は、薬学(薬物送達学・安全科学)、医学(ウイルス学・免疫学)の融合連携を基に、上記の課題を克服することで、あらゆる世代に有効かつ安全なワクチン開発に取り組んでいる。特に、ワクチン開発の日本におけるリーディングカンパニーである一般財団法人 阪大微生物病研究会との強固な連携のもと、実用化に資する新規ワクチンの開発に取り組んでおり、以下にその一例を紹介する。
・樹状細胞標的化ペプチドの開発:これまで、抗原の樹状細胞への効率的な送達を目指し、様々な抗原送達キャリアの開発が世界中で進められてきた。例えば、リポソームなどの粒子状物質が細胞に取り込まれやすいことから、正電荷リポソームなど、多くの粒子状物質が抗原送達キャリアとして基礎研究されてきた。しかし、細胞傷害性を示す粒子状物質が多いこと、作製が極めて煩雑であること、十分な効果を発揮可能な送達キャリアに乏しいこと、多くの場合、高価であることなどから、数十年に渡る基礎研究にも関わらず、臨床展開されるには至っていない。そのため、効果・安全性に優れることは勿論のこと、より簡便かつ低コストな抗原送達キャリアの開発、即ち、感染症対策に資する基盤技術の開発が喫緊の課題となっている。本観点で、我々はこれまでに、独自のファージ表面提示法を駆使し、樹状細胞選択的に結合可能な樹状細胞標的化ペプチドを先駆けて創製したうえで、抗原に付与するだけで、リンパ節中の樹状細胞に効率的に抗原を送達可能なばかりか、アジュバントを加えずとも強力に抗原特異的抗体産生を誘導可能であることを見出している。さらに、アジュバントと併用することで、抗原特異的CD8陽性T細胞も強力に誘導可能であり、感染症ワクチンのみならずがんワクチンへの展開も期待されている。現在、本ペプチドの免疫誘導メカニズムの解明などを推進すると共に、新たな抗原送達用ペプチドの創製にも取り組んでいる。
・アジュバントの開発研究:ワクチン開発において、強力な免疫応答の誘導には、抗原を樹状細胞へ効率的に送達するのみならず、アジュバントによる樹状細胞の活性化が必要不可欠となっている。従来よりアルミニウム塩がアジュバントとして汎用されてきたものの、Th2型免疫応答しか誘導しないなど、致命的問題も抱えてきた。その点、CpG核酸やpoly(I:C)といった核酸系アジュバントは、Th1型免疫およびCD8陽性T細胞を強く活性化可能なことから、感染症のみならず、がんに対するワクチンアジュバントとしても期待されている。事実、近年、CpG核酸をアジュバントとして含有する、B型肝炎に対するワクチンが米国で上市されている。これら核酸系アジュバントは、細胞内に取り込まれた後、エンドソーム内でToll様受容体と結合するものの、細胞外からエンドソームに至る経路には不明な点も多い。現在、核酸系アジュバントの細胞内取り込み機構の解明を図ると共に、得られた知見を基に、新規アジュバントのデザイン研究を試みている。
・新規インフルエンザワクチンの開発研究:インフルエンザウイルスに対するワクチンは、最も身近なワクチンであるものの、未だ多くの課題を抱えている。例えば、ワクチン株と流行株の抗原性が異なった場合、十分なワクチン効果を期待できないため、同一亜型内でワクチン株と抗原性の異なる株に対して、交差反応性を示すワクチンの開発が期待されている。本観点から我々は、アジュバントの最適化や抗原の最適化などによる、交差反応性を有する新たなワクチンの開発を進めている。例えば、1)TLR9リガンドであるCpG核酸をアジュバントに用いることで、抗原特異的な非中和型IgG2の選択的誘導に起因する抗体依存性細胞障害(ADCC)により、ヘテロローガスな株を防御可能であること、2)非中和型IgG1及びIgG2を共に産生誘導するアジュバントにおいては、IgG1によりIgG2のADCC活性が競合阻害されることで、IgG2の防御能が低下することを明らかとしており、IgG2を選択的に誘導可能なアジュバントの有用性を認めている。さらに、Neuraminidase(NA)が抗原として有用であることも確認しており、NAに対する抗体産生を増強可能な新たなワクチン開発を進めている。。
・マイコプラズマ肺炎の病態形成メカニズムの解明とワクチン展開:Mycoplasma pneumoniae(以下、マイコプラズマ)は、市中肺炎における原因菌の20~30%を占める病原微生物である。マイコプラズマに起因する肺炎(マイコプラズマ肺炎)の罹患者の約70%が14歳以下であると共に、小児においては、マイコプラズマ肺炎患者の約20%が入院を余儀なくされるなど、重篤な症状を呈する。成人においても、長期間続く乾性咳嗽によるQuality of lifeの低下や、気管支喘息の悪化を誘発することから社会問題となっている。治療にはマクロライド系抗菌薬が用いられるものの、近年、マクロライド系抗菌薬耐性マイコプラズマの出現により、小児に使用できる薬剤は極めて限局されている。さらに1960年代に、不活化マイコプラズマを用いたワクチン開発が進められたものの、ヒトにおいて、マイコプラズマ感染による肺炎症状がワクチン接種により悪化したという報告も存在し、現在も、ヒトにおけるワクチンは存在しない。本観点から、既存の抗菌薬に代わる新たな治療薬や、有効で安全なワクチンの開発が世界的急務となっている。そこで我々は、マイコプラズマ肺炎の病態形成メカニズムの解明と共に、得られた知見を基にしたワクチン開発を進めている。
2015年から2018年辺りまでの研究概要
我々はこれまでに、体内動態を制御し得る抗原送達キャリアの開発を目的に、粒子のサイズと体内動態の連関を精査してきました。その結果、粒子径100nm以下のナノサイズのナノ粒子が、100nm以上の粒子と比較して、リンパ節への移行性が顕著に上昇すること、さらに、樹状細胞といった抗原提示細胞に効率良く取り込まれることを明らかとしています。本知見は、適切なナノ粒子をデザインすることで、抗原やアジュバントを効率的にリンパ節・抗原提示細胞に送達させ、副作用を誘発することなく、ワクチン効果のみを誘導し得ることを示しています。そこで現在、蛋白質/抗体工学や高分子化学の手法を駆使し、無機物、蛋白質、ペプチドなど、様々な素材から構成される機能性ナノ粒子のデザイン研究を推進しています。特に、・アジュバント送達キャリアの全身・免疫組織・細胞レベルでの詳細な動態を解析したうえで、ナノ粒子の物性と動態、有効性・安全性との連関情報を基に最適粒子設計することで、抗原送達キャリアの最適化を図っています。さらに、網羅的な分子探索技術を駆使し、ワクチンアジュバントの分子標的として優れたサイトカインやTLRシグナルを活性化し得る低分子化合物やバイオ化合物(ペプチドなど)の探索および最適デザインを図っています。そのうえで、ワクチン開発に資するこれら基盤技術を活用することで、インフルエンザやA型連鎖球菌といったウイルスや細菌に対する新規ワクチン開発をも推進しています。また、開発した抗原送達キャリアやアジュバントの安全性研究にも重点をおいており、「ワクチン効果」は当たり前で、老若男女が安全・安心に接種できるワクチン開発を目指しています。これら研究は、インフルエンザ、エボラ出血熱やHIVといった感染症のみならず、将来的には、がんやアルツハイマー病、糖尿病といった疾患に対するワクチン開発へも直結するものであり、その波及効果は図りしれないなど、社会的ニーズに富んだ薬学研究といえます。
1) 次世代型ワクチンの開発に資するワクチン抗原・アジュバントの送達キャリアデザイン
2) 次世代型ワクチンの開発に資する新規アジュバントのデザイン
3) 感染症に対する免疫防御機構の解明
4) 実用化を目指した新興・再興感染症に対するワクチン開発
2015年までの研究内容の概要<これら内容を基盤に、上述した研究を推進しています> 現在、医薬品の概念は広がり続けており、バイオ医薬(蛋白医薬、核酸医薬など)やナノ医薬といった最先端医薬が続々と台頭し、難病や新興・再興感染症などの克服が期待されている。一方で、20世紀後半から期待され続けてきた蛋白医薬をみても、抗IL-6受容体抗体といった抗体医薬などの一部の例外を除き、その臨床応用が順調に進んでいるとは言い難い。これは、最先端医薬を含めた医薬品の開発において、未だに、有効性の欠如のみならず、動態の不備や毒性発現が大きな障壁となっていることに起因する。従って、最先端医薬の成功の鍵は、薬物動態(ADME)と毒性(T)の連関【ADMET】を追求したうえで、リスクとベネフィットを制御し得る創薬基盤技術を如何に開発するかにかかっていると言っても過言では無い。本観点から私は、薬物送達学と毒性学/安全科学を軸として、ADMETを基盤とした薬学的視点から、❶バイオ医薬の医薬品化に叶う新たな創薬基盤技術の構築、❷ナノ素材の安全性を加味した最適粒子設計によるナノ医薬の開発と❶を融合した、新興・再興感染症の克服に資するワクチン開発を試みてきた。
❶これまでに、蛋白質工学や高分子化学を駆使することで、ペプチドや蛋白質(サイトカインや抗体)の体内動態を高度に制御しつつ、目的とする生理作用のみを発揮可能な医薬価値に優れた蛋白質・ペプチド医薬の開発に資する創薬基盤技術を構築してきた。特に、腫瘍壊死因子(TNF)スーパーファミリーを標的として、①数億種類以上ものペプチド・蛋白質構造変異体ライブラリの中から、目的作用を有する人工ペプチド・蛋白質を迅速創製可能なファージ表面提示法を駆使することで、生物活性・体内安定性・レセプター特異性の向上といった有用機能が付与された機能性人工ペプチド・蛋白質を自由自在に迅速創製可能な基盤技術の構築に成功してきた。さらに、ペプチド・蛋白質・ウイルスベクターの体内動態制御を目的に、②DDS機能(標的指向能・薬物徐放化能など)を有した機能化高分子キャリアの新規設計など、圧倒的な医薬価値を有するペプチド・蛋白質医薬の創製基盤を先駆けて確立した。
❷さらに、新興・再興感染症の克服に資するワクチン開発を目指し、ADMETの理解と制御による、「アジュバントと抗原送達法の開発、そして安全科学/毒性学的観点からのワクチンリスク解析と安全性確保」を推進してきた。アジュバントについて、③上述の①で構築した機能改変型人工TNF-αが経鼻アジュバントとして有望であることを示すと共に、④IL-18やIL-33といったIL-1ファミリーが、最強の粘膜アジュバントであるコレラトキシンよりも強力かつ安全な経鼻アジュバントになり得ることを先駆けて見いだした(特許5539660号)。これら知見を最大限に活用し、防御免疫や安全性をさらに高めるには、「如何に抗原を効率よく、確実に、免疫担当細胞に送達するか」が肝心であり、抗原送達キャリアの設計が第一義的に最重要と言える。そこで、粒子径100nm以下の素材であるナノ素材を用いた抗原送達キャリアの創製を目的に、⑤ナノ素材の物性—体内・細胞内動態—有効性・安全性の連関情報を収集し、ナノ素材の動態特性と安全性は、粒子サイズ、粒子形状、表面電荷、プロテインコロナといった物性により運命付けられ得ることを先駆けて見いだした。そのうえで、⑥抗原を細胞質に導入し細胞傷害性T細胞をも誘導可能な抗原送達キャリアや、抗原を粒子表面に吸着させるだけで、経鼻免疫によりコレラトキシンと同等以上の強い抗体産生を誘導し得るキャリアを見いだしており、感染症に対する有効かつ安全なワクチン開発に向けた基盤が整っている。現在、これまでに構築してきた創薬基盤技術を土台に、感染症予防に資する粘膜ワクチン開発に注力している。特に、ワクチンリスクへの懸念が増していることから、有効なのは当たり前で、妊婦・胎児・新生児など、ワクチン接種が必須であるものの、副作用が誘発しやすい脆弱な個体を含め、老若男女を問わず安心して使用できるワクチンを開発したいと念じている。