ゲノム編集技術により精子の受精能力を制御する 遺伝子ファミリーを発見(伊川研がPNASに発表)
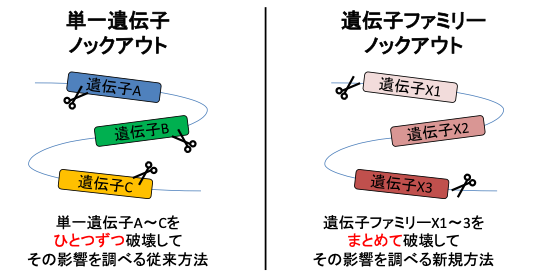
本研究所遺伝子機能解析分野 藤原祥高 招へい准教授(現在: 国立循環器病研究センター室長)、野田大地 助教、伊川正人 教授らの研究グループは、ベイラー医科大学のMartin M. Matzuk 教授らの研究グループとの国際共同研究により、雄の生殖器官で発現する遺伝子ファミリー(※1)が精子の受精能力に必須であることを世界で初めて明らかにしました。本研究グループは、ゲノム編集(※2)技術CRISPR/Cas9(※3)を駆使して迅速かつ高効率に遺伝子ノックアウト(※4)マウスを作製し、これまでに雄特異的に発現する遺伝子93個が生殖能力に必須ではないことを明らかにしてきました(PNAS. 2016(研究内容紹介はこちら); Andrology. 2019; Biol Reprod. 2019)。しかし、これらの報告は単一遺伝子を対象とした研究でしたが、遺伝子の中には似た配列や機能を持つ遺伝子ファミリーがあることが知られています。このような遺伝子ファミリーの場合、ひとつの遺伝子を破壊しても他のファミリー遺伝子が機能補償することで表現型が現れない(隠れてしまう)ケースが多くあったため、これまで遺伝子ファミリーを対象とした個体レベルでの機能解析はあまり進んでいませんでした(左図)。
わが国では、約6組に1組の夫婦が不妊の検査や治療を受けており、不妊症は社会問題のひとつになっています。本研究では、解析が進んでいなかった雄特異的な発現を示す遺伝子ファミリーに着目し、近年注目されているゲノム編集技術CRISPR/Cas9の利点を最大限活用することで、雄性生殖に必須な遺伝子ファミリーの同定に成功しました(図1、図2)。
本研究成果により、男性不妊の新たな原因遺伝子として診断・検査の対象となり、治療薬や避妊薬の開発へと繋がることが期待されます。
本研究は「受精卵全能性を統御する遺伝子群の単離と機能解析(研究代表者:伊川正人)」による支援を受けて行われました。
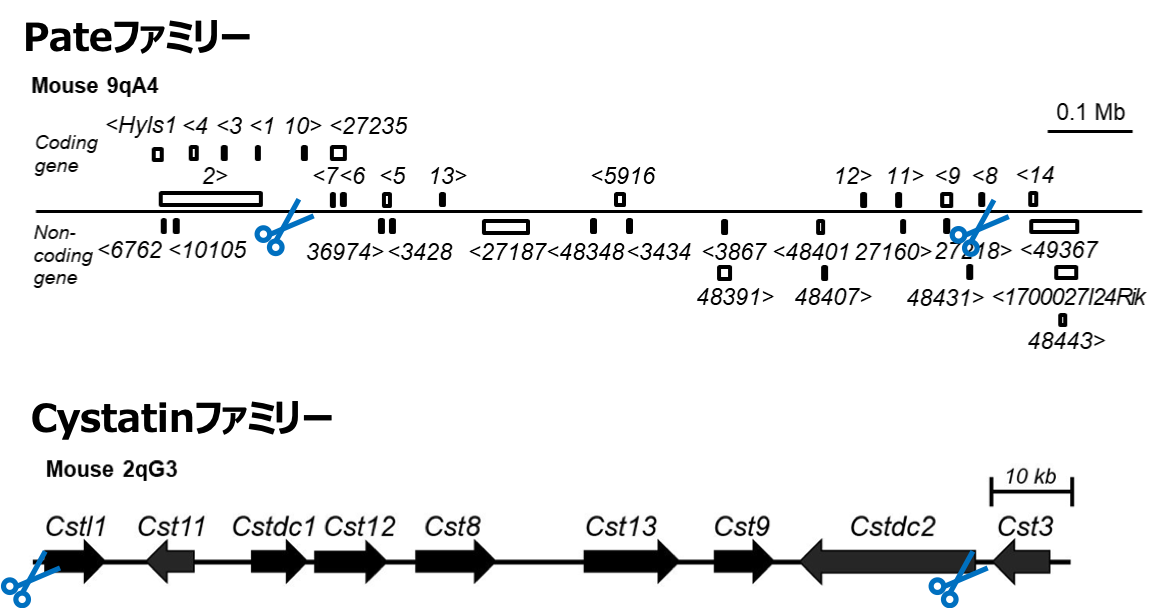
- 図1)今回同定した遺伝子ファミリーであるPateファミリーとCystatinファミリーの遺伝子地図
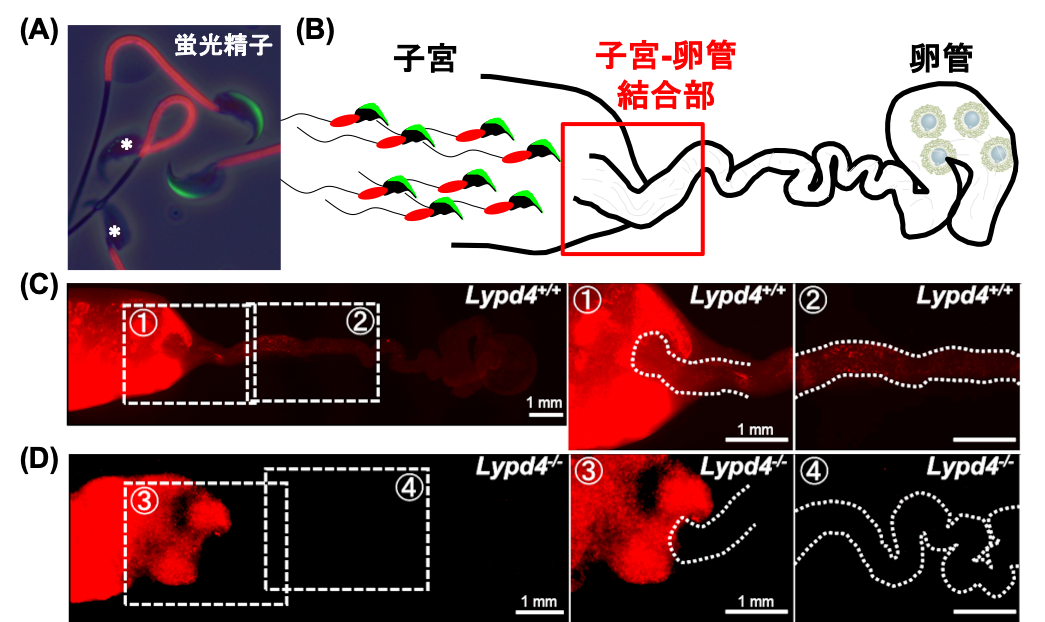
- 図2)今回作製した遺伝子KOマウスは精子の子宮から卵管への移行不全が原因で雄性不妊になることが蛍光精子を用いた観察から判明した。
- (A)緑色と赤色蛍光を持つ精子(*先体反応後の精子も判別可)、(B)雌性生殖路の概略図、精子は子宮(左)から卵管(右)へと移行して受精に至る。(C)野生型マウス精子の様子、視野①②両方で精子を確認できた。(D)遺伝子KOマウス精子の様子、③では精子を確認できたが、④では確認できなかった。
本研究成果は、2019年8月27日(火)午前4時(日本時間)以降に米国科学誌「米国科学アカデミー紀要(PNAS)」(オンライン)に掲載されました。
タイトル:“Identification of multiple male reproductive tract-specific proteins that regulate sperm migration through the oviduct in mice”
著者名:Fujihara Y, Noda T, Kobayashi K, Oji A, Kobayashi S, Matsumura T, Larasati T, Oura S, Kojima-Kita K, Yu Z, Matzuk MM, and Ikawa M.
用語説明
※1 遺伝子ファミリー
同じ遺伝子に由来するため、配列や機能が互いに類似している遺伝子群のこと。進化の過程で、遺伝子重複により同じ染色体周辺に集合した結果、クラスターを形成していることが多いが点在していることもある。
※2 ゲノム編集
ゲノム(遺伝子を含む遺伝情報)上の任意の場所で、欠失・挿入などの変異を導入できる遺伝子改変技術のひとつ。
※3 CRISPR/Cas9(クリスパーキャスナイン)
ゲノム編集技術の一種で、細菌の獲得免疫システムとして発見された機構。この機構を応用することで、Cas9ヌクレアーゼによるDNAの切断・修復を利用して変異を効率良く導入できる。
※4 ノックアウト
遺伝子改変技術により特定の遺伝子に変異を導入して、その遺伝子の機能を破壊すること。ノックアウト(KO)動物を解析することで、生体内での機能を解明することができる。