ゴルジ体の新規糖転移酵素を発見(木下研がNature Commun.誌に発表)
哺乳動物細胞の約150種類ほどのタンパク質は、糖脂質であるグリコシルホスファチジルイノシトール(GPI)と呼ばれる翻訳後修飾によって細胞の表面につなぎとめられています。GPIは細胞内の小胞体で作られ、タンパク質へと付加され、GPIアンカー型タンパク質となります。GPIアンカー型タンパク質は、小胞体やゴルジ体でGPI部分の構造変化を受けながら細胞表面へと運ばれます。哺乳動物細胞のGPIの糖鎖部分の化学構造は、グルコサミンやマンノースからなる主要構造と、N-アセチルガラクトサミン(GalNAc)から始まる側鎖構造から構成されることが30年前に報告されました。これまでの研究で、私たちはGPIの主要構造が作られる仕組みの大部分を明らかにしてきましたが、GalNAcから始まる側鎖構造が作られる仕組みについては不明なままでした。
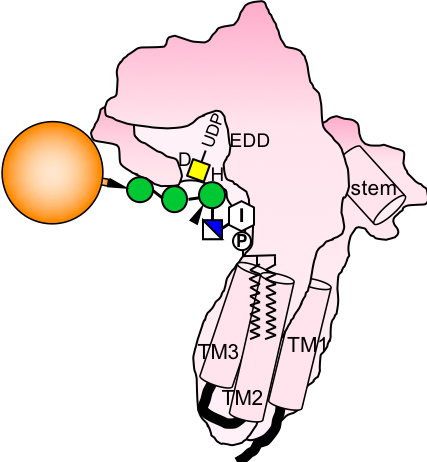
今回、私たちはGPIのGalNAc側鎖が作られる仕組みを解明するため、その最初の反応を担うGPI-GalNAc転移酵素を探索しました。その結果、機能が不明でTMEM246と呼ばれていたタンパク質をその候補として見つけ出し、これをPGAP4(post-GPI attachment to proteins 4)と改めて名付けました。PGAP4はゴルジ体に局在する3回膜貫通型のタンパク質であり、GPI-GalNAc転移酵素そのものであることが明らかとなりました。これまでに糖転移酵素は非常に多くの種類が見つかっていますが、ゴルジ体に局在する糖転移酵素はすべて1回膜貫通型のII型膜タンパク質であることが知られていました。このことから、PGAP4はこれまでの常識から外れるユニークな構造を持つ糖転移酵素であることがわかりました。さらに、PGAP4の立体構造モデルを作製し解析したところ、PGAP4の膜貫通領域近傍にGPIの糖鎖部分と結合しうる凹みを見出しました(図)。これらの結果から、PGAP4がGPIを認識し、GalNAcを付加する仕組みの一端を明らかにすることができました。この研究は、GPIの側鎖構造の持つ生理的意義の解明や、ゴルジ体の糖転移酵素に対する新たな概念の創出につながると期待されます。
本研究は微生物病研究所の籔本難病解明寄附研究部門、感染症メタゲノム研究分野、中央実験室質量分析室と理化学研究所 糖鎖構造生物学研究チーム(山口芳樹チームリーダー)および中国 江南大学 生物工程学院(藤田盛久教授)との共同研究で行われたものです。