松浦研の研究成果がPLoS Pathogens誌に掲載されました
C型肝炎ウイルス(HCV)は脂肪肝、肝硬変、肝細胞癌等の慢性肝疾患の主要原因ウイルスですが、その感染環は未だ不明な点が多く残されています。HCV粒子は脂質を豊富に含んでおり、その性状が血中のリポタンパク質(※1)に類似していることからlipoviroparticles (LVPs)と呼ばれています。これまでの報告から、LVPsはHCVの粒子形成や細胞への侵入に重要であることが示唆されていましたが、詳細は不明なままでした。
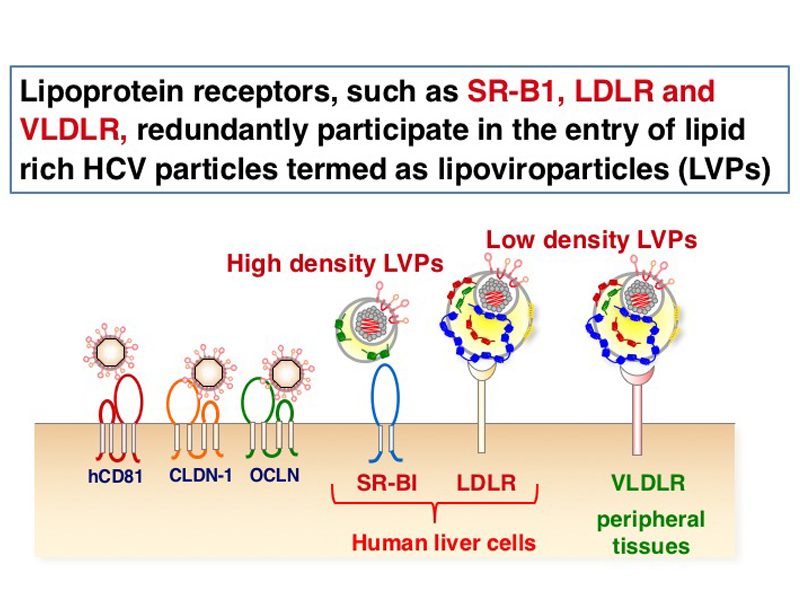
リポタンパク質はリポタンパク受容体を介して細胞に取り込まれますが、肝臓に豊富に発現しているリポタンパク質受容体のSR-B1とLDLRは、HCVの感染受容体の候補分子です。CRIPSR/Cas9システムを用いて各種ノックアウト細胞株を作成したところ、SR-B1とLDLRのダブルノックアウト細胞で、ウイルスの感染効率が劇的に低下することがわかりました。さらに、ダブルノックアウト細胞で、SR-B1またはLDLRを過剰発現させた場合、片方のタンパク質のみを発現させれば野生型細胞と同レベルの感染効率があることが明らかになりました。つまり、両方のタンパク質がなくても、どちらかが充分量あればHCVは細胞に感染できることから、SR-B1とLDLRがHCVの細胞内への侵入に相補的に機能していると考えられます。また、主に肝臓以外の組織に発現しているリポタンパク質受容体のVLDLRも、SR-B1やLDLRと同等の機能を持つことを明らかにしました。
これらリポタンパク質受容体のリポタンパク質との結合能がHCVの侵入に重要であり、HCVはLVPsの密度に依存してリポタンパク質受容体を使い分けていることが示されました。
本研究によって、HCVの侵入過程におけるリポタンパク質受容体の役割が解明され、HCV感染を阻止できるリポタンパク質受容体の拮抗薬の開発が期待されます。
※1)リポタンパク質
水に不溶性である脂質を血中で運搬するための脂質とタンパク質の複合体。LDL、HDL、VLDLなどがある。これらのリポタンパク質として運ばれた脂質が肝臓に発現するSR-B1やLDLRリポタンパク受容体を介して取り込まれる。HDLは動脈壁などに溜まった脂質(コレステロール)を回収して運び肝臓に戻すので、善玉のリポタンパク質と呼ばれる。