先天性PIGO欠損症モデルマウスの確立とその遺伝子治療(木下研がNat. Commun.誌に発表)
本研究所 村上良子特任教授、木下タロウ特任教授らの研究グループは先天性GPI欠損症の一つであるPIGO欠損症のモデルマウスを確立し、アデノ随伴ウイルスを使ったゲノム編集による遺伝子治療の有効性を示しました。この研究は、高等共創研究院鈴木啓一郎教授、医学系研究科小児科学、遺伝子機能解析分野、脳情報通信融合研究センター(CiNet)吉岡芳親特任教授、旧京都大学霊長類研究所井上謙一助教、との共同研究です。
概要
GPI アンカー型タンパク質(GPI-AP)の生合成に関わる遺伝子として現在までに30個の遺伝子が知られています。これらの遺伝子の変異によりそれぞれがコードするタンパク質の発現や活性の低下が起こり、細胞膜表面のGPI-APの発現低下や構造異常をきたすことにより先天性GPI欠損症(IGD)を発症します。主な症状は、知的障害、運動発達の遅れ、てんかんであり、その他の症状として、高アルカリフォスファターゼ血症、末節骨の短縮、爪の低形成などの手指・足趾の異常、難聴、内臓奇形などを来します。現在までに24個の遺伝子変異によるIGDが報告されており指定難病に認定されています。
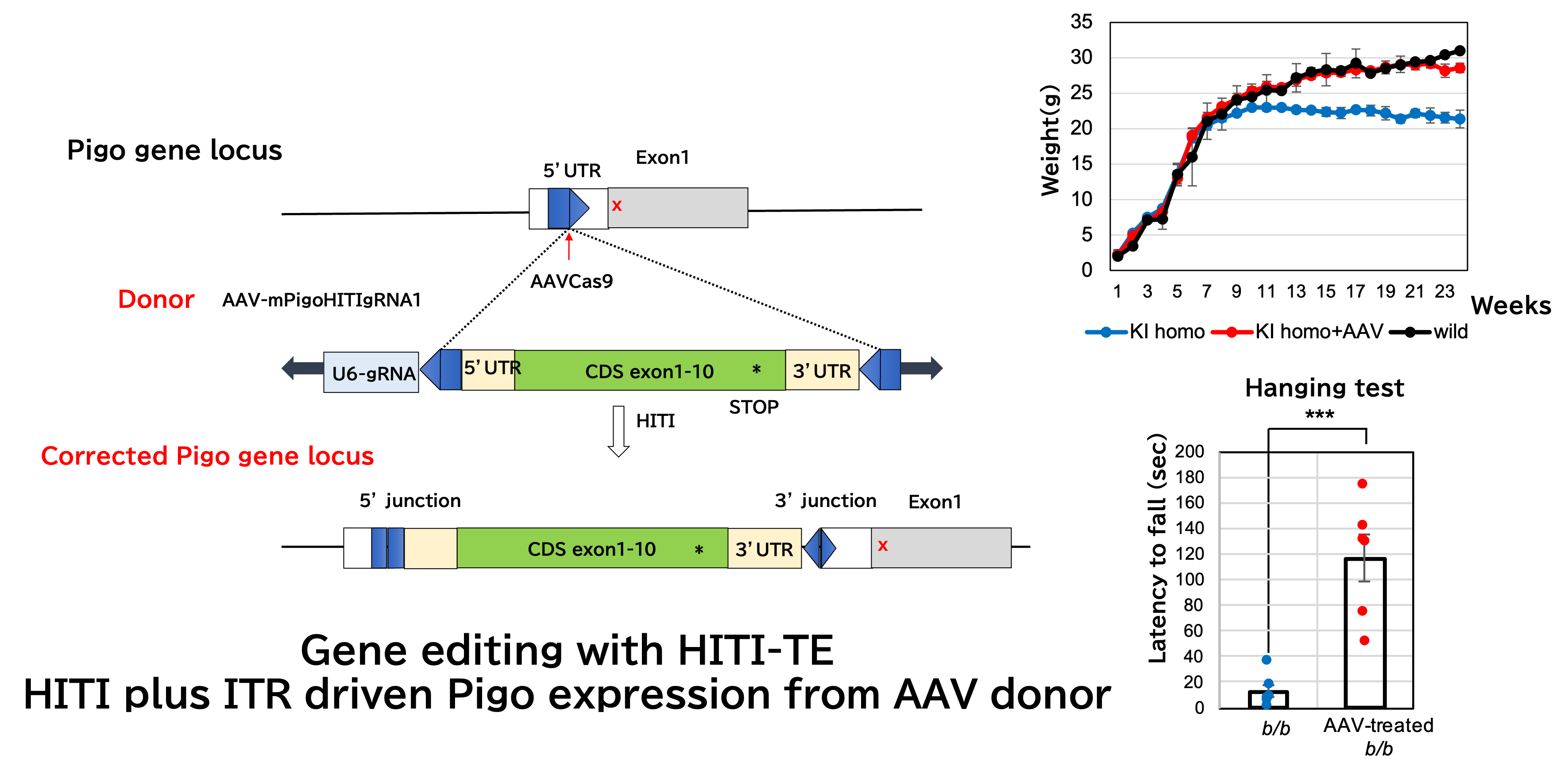
伊川教授らのサポートを受けて、CRISPR/Cas9 システムを用いた遺伝子編集により、PIGO欠損症患児と同様のミスセンス変異を持つA,B,C, 3種類のノックインマウスを作製しました。最も重症度の高いT130N変異を持つホモ接合のノックインマウス群(KI homo)と複合ヘテロ接合のノックイン/ノックアウトマウス(KIKO) 群では、体重増加不良、けいれん、振戦を認め、また野生型マウスと比較して、血漿中アルカリホスファターゼ (ALP)の有意な上昇、顆粒球表面のGPI アンカー型タンパク質であるGr-1の有意な発現低下を認め、これらの表現型はIGDの症状を反映しており、モデルマウスとして有用であることがわかりました。このマウスを使ってマウスで神経組織への感染効率の高い、アデノ随伴ウイルス(AAV)PHPeBベクター とhomology-independent targeted integration (HITI) システムによるゲノム編集を使った遺伝子治療 HITI-TE (HITI assisted by a low level of transgene expression)の効果を解析しました。生直後にAAV donorとAAVCas9を1011gc/mouseずつ静脈内投与し、体重増加、振戦の程度、易けいれん性、筋力低下(hanging test)、Gr-1の発現、血漿中アルカリホスファターゼ値について評価しました。 遺伝子治療によりこれらの全てについて改善がみられました。HITI-TE法はAAVCas9とPigoの全長を入れたAAV donorを同時に感染させ、Pigo cDNAを内在性プロモーターの下流に挿入して正常Pigoの発現を得ると同時に、エピゾームとして存在するAAV donorのITRプロモーター活性により発現するPigoの効果も期待できます。この結果からIGDの神経症状が生後早期に治療すれば、可逆的であることを示しています。今後まずはゲノム編集を伴わないAAV9による治療法で安全性と効果を示し、ヒトでの実用化を目指したいと考えています。
本研究成果は2022年6月3日にNature Communicationsに掲載されました。
タイトル: Establishment of mouse model of inherited PIGO deficiency and therapeutic potential of AAV-based gene therapy
著者: Ryoko Kuwayama, Keiichiro Suzuki, Jun Nakamura, Emi Aizawa, Yoshichika Yoshioka, Masahito Ikawa, Shin Nabatame, Ken-ichi Inoue, Yoshiari Shimmyo, Keiichi Ozono, Taroh Kinoshita, Yoshiko Murakami* (* Corresponding Author)