ギョッ! 魚で “がん発生超初期”の新たなメカニズムを解明(石谷研がNat. Commun.誌に発表)
本研究所生体統御分野 石谷太教授、同大学院生の原岡由喜也さん(医学系研究科博士課程)らの研究グループは、これまで未知であった「がん発生超初期のメカニズム」の一端を明らかにしました。
<研究成果のポイント>
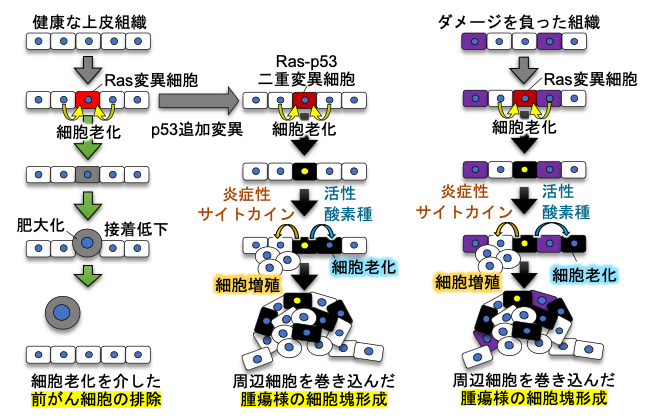
- 患者やマウスモデルを用いた解析から、がんの発生・悪性化にかかわるメカニズムが明らかにされてきたが、がん発生超初期のメカニズムは未解明である。そこで、イメージングに適した小型魚類ゼブラフィッシュ※1を用いて、上皮組織に生じた“前がん細胞※2”の挙動を可視化解析する系を構築した。
- イメージング解析※3により、健康な上皮に単独遺伝子変異を持つ前がん細胞が出現すると、隣接正常細胞がその出現を感知して前がん細胞を細胞老化※4(増殖停止)させ、さらに、体外排出を促すことを発見した。これは免疫細胞に依らない隣接細胞間相互作用を介したがん抑制機構である。
- 前がん細胞にがん抑制遺伝子p53の変異が追加される(二重変異細胞になる)と隣接細胞による排除を免れて生存して炎症性サイトカインや活性酸素に放出し、隣接正常細胞に増殖と老化を誘導しながら初期の腫瘍を形成する(がんが起こる)ことがわかった。
- ダメージ細胞(老化細胞)が蓄積した上皮では、前がん細胞の排除活性が低下しており、前がん細胞による隣接細胞を巻き込んだ腫瘍形成が起きやすいこともわかった。
- 今回発見した「がん抑制機構、がん発生機構」は、老化に起因するがん発生のメカニズムに新たな視点をもたらす重要な発見である。
<概要>
本研究では、従来の研究方法では解析困難であった「がん発生超初期」のメカニズムを調べるために、イメージング解析に適し、かつヒト同様の脊椎動物である小型魚類ゼブラフィッシュを用いて「生体内に生じた変異細胞(前がん細胞)の挙動を解析する系」を構築しました。この系を用いた解析により、①健康な上皮組織に単独変異を持つ前がん細胞が生じた際には隣接正常細胞がこれを感知して細胞老化を誘導して体外へ排除すること、②前がん細胞にp53遺伝子変異が追加された場合、あるいは上皮組織にダメージ細胞(老化様細胞)が多く存在する場合は、前がん細胞は隣接細胞による排除を受け付けずに生存し続け、逆に隣接細胞に老化と増殖を誘導して初期の腫瘍を形成することを発見しました。この成果は「ヒトのがん発生機序」や「がん発生リスクの加齢による増加」に新たな理解と視点をもたらすと期待されます。
本研究成果は、2022年3月18日(金)19時(日本時間)に、英国科学誌「ネイチャーコミュニケーションズ」に掲載されました。
タイトル:Zebrafish imaging reveals TP53 mutation switching oncogene-induced senescence from suppressor to driver in primary tumorigenesis
著者名:Yukinari Haraoka, Yuki Akieda, Yuri Nagai, Chihiro Mogi, and Tohru Ishitani
<用語説明>
※1 ゼブラフィッシュ
ヒマラヤ周辺の温帯地域の池の浅瀬や田んぼのそばに棲息するコイ科の淡水魚。胚や稚魚の体が小さく透明なため、イメージング解析に最も適したモデル脊椎動物であると考えられている。また、人と類似した遺伝子、細胞、臓器を有し、かつ、容易に飼育・実験操作できることなどから、「ヒト疾患研究の第3のモデル動物」として米国NIH(国立衛生研究所)に指定されている(第1、第2のモデルはマウスとラット)。
※2 前がん細胞
がん関連遺伝子(がん遺伝子やがん抑制遺伝子)に変異を持つ細胞。がんは少数の前がん細胞を起源として生じると考えられているが、あくまで仮説に過ぎない。
※3 イメージング解析
生物の体内における細胞動態、細胞内の分子動態を可視化する研究方法。最も多くの情報を得ることができ、生命現象を最も効果的に理解できる方法の一つである。対象とする生物の透明度が高ければ体内深部までイメージングが可能で、かつ対象とする生物が小さければ分子動態、細胞動態、個体の変化を同時に把握できる。このため、小さく透明度の高い生物に対して極めて有効である。
※4 細胞老化
細胞が異常を感知すると増殖を不可逆的に停止する現象。DNA損傷、がん遺伝子の活性化、ストレスなどで誘導され、異常な細胞の増殖を防ぐ安全装置の役割も果たす。一方で細胞老化を起こした細胞が炎症性サイトカインなど様々な分泌因子を高発現することで、逆に慢性炎症を引き起こすことも知られている。