精子の運動を制御する分子を発見 (伊川研がPNASに発表)
遺伝子機能解析分野の宮田治彦准教授、伊川正人教授らの研究グループは、SPATA33が精子の運動性を制御する機構を明らかにしました。
これまで、脱リン酸化酵素 (※1) であるカルシニューリン (※2) が受精に必要な精子の運動性を制御することが知られていました(Science 2015, プレスリリース)。カルシニューリンの阻害剤をオスマウスに投与すると可逆的に不妊になることから、カルシニューリン経路は男性避妊薬の有望な標的だと考えられています。しかし、カルシニューリンは免疫においても重要な機能をもつため、免疫細胞のカルシニューリンを阻害してしまうと免疫機能も抑制されるという問題点がありました。そのため、精子特異的にカルシニューリンの機能を制御する機構の解明が望まれていました。
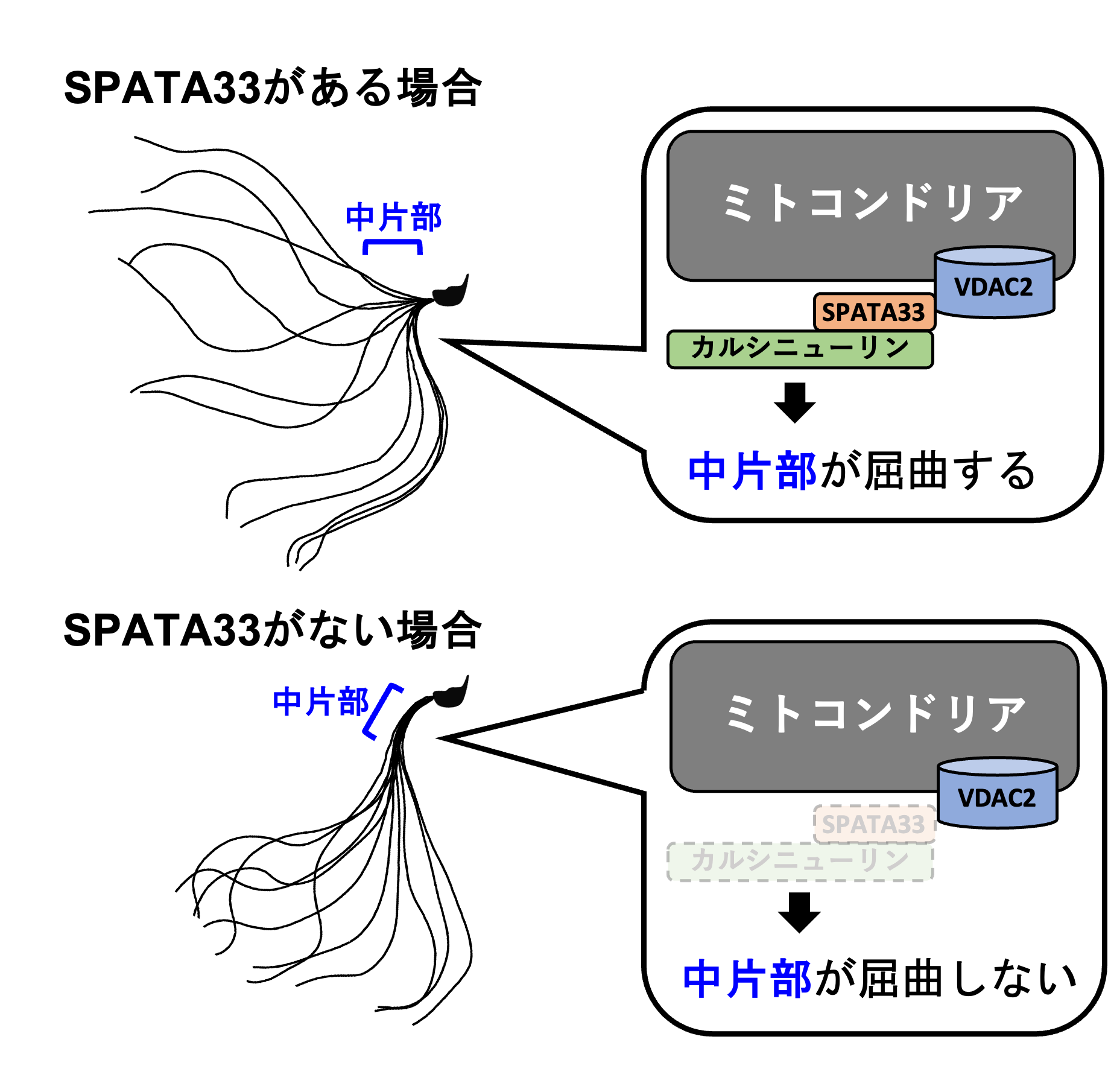
研究グループは、カルシニューリンに結合するタンパク質の多くがもつPxIxITモチーフ (※3) に着目しました。約2万個あるマウスタンパク質の中から、PxIxITモチーフを含み、且つ、精巣特異的に発現する8つのタンパク質を解析対象に絞りました (図1)。このうち解析が進んでいない3つのタンパク質について、ゲノム編集技術 (※4) を用いて欠損マウスを作製しました。その結果、SPATA33を欠損したマウスが、カルシニューリンを欠損したマウスと同様に精子運動性と生殖能力の低下を示しました。さらに解析を進めることにより、SPATA33はカルシニューリンの局在を制御していることを明らかにしました。SPATA33が欠損すると、カルシニューリンが精子尾部の中片部へ局在できません (図2)。そのため、中片部が屈曲できず、精子運動性が低下します。
世界統計では、妊娠の約4割が予定外の妊娠とされます。日本でも、毎年約20万件の人工妊娠中絶が実施されており、その理由の1つとして予定外の妊娠があげられます。しかし、女性用経口避妊薬が存在する一方、男性用経口避妊薬の開発は成功していません。SPATA33を標的にすることで、精子特異的にカルシニューリンの機能を阻害する男性避妊薬の開発が期待されます。また、SPATA33によって精子運動性が制御される機構が明らかになり、精子運動性低下による不妊症の原因究明や診断に新たな視点が加わりました。
本研究成果は、米国科学誌「米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America、PNAS)」に掲載されます。
タイトル:“SPATA33 localizes calcineurin to the mitochondria and regulates sperm motility in mice”
著者名:Haruhiko Miyata*, Seiya Oura, Akane Morohoshi, Keisuke Shimada, Daisuke Mashiko, Yuki Oyama, Yuki Kaneda, Takafumi Matsumura, Ferheen Abbasi, and Masahito Ikawa# (*筆頭著者, #責任著者)
用語説明
※1 脱リン酸化酵素
- タンパク質のリン酸基を脱離させる酵素。これによりタンパク質の機能を制御している。
※2 カルシニューリン
- カルシウム依存性の脱リン酸化酵素であり、精子運動性だけでなく免疫にも関与する。カルシニューリンの阻害剤であるシクロスポリンAやタクロリムスは免疫抑制剤として用いられている。
※3 PxIxITモチーフ
- プロリン(P)-X-イソロイシン(I)-X-スレオニン(T)というアミノ酸配列 (Xはどのアミノ酸でも良い)。カルシニューリンに結合する多くのタンパク質がこのアミノ酸配列をもつ。
※4 ゲノム編集技術
- ゲノム(遺伝子を含む遺伝情報)上の任意の場所で、欠失・挿入などの変異を導入できる遺伝子改変技術のひとつ。2020年のノーベル化学賞はゲノム編集技術の開発者に贈られた。