がん細胞の新たな生存戦略を解明(三木研がDev. Cellに発表)
大阪大学微生物病研究所の船戸洋佑助教、三木裕明教授らの研究グループは、がん組織内の酸性化へのがん細胞の新たな適応機構を明らかにしました。
これまでがん組織内が酸性化していることはよく知られていましたが、なぜそのような通常細胞にとってストレスの多い環境下でがん細胞が生存し増殖し続けられるのか、その仕組みについてはほとんど解明されていませんでした。
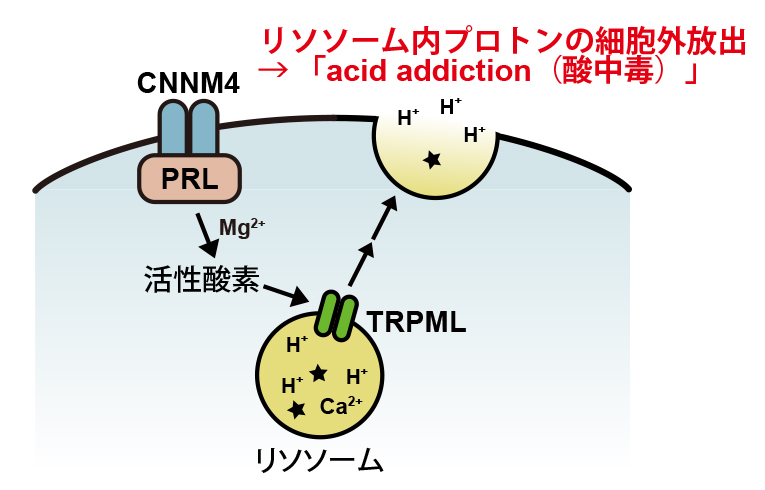
今回、船戸助教と三木教授らの研究グループは、悪性ヒトがん組織で高発現する分子PRLにより、リソソーム※1を利用したプロトン放出が活性化され、がん組織内の酸性環境下でも活発に増殖し続けられるようになる「acid addiction」が生じることを解明しました(図)。
がん細胞を取り巻く環境(がん微小環境)の特徴として知られる低酸素状態への応答機構の研究はこれまで盛んに行われ、昨年にはノーベル生理学・医学賞が授与されました。また、それに応答してがん組織内で活発に誘導される血管新生の阻害剤(ベバシズマブ、商品名アバスチンなど)はすでにがん治療薬として広く用いられています。一方でがん微小環境のもう一つの顕著な特徴である酸性化状態への応答機構の研究はほとんど進んでおらず、本研究で明らかにしたacid addictionの仕組みを標的とした、新たながん治療法開発への展開が今後期待されます。
本研究成果は、2020年9月12日(土)0時(日本時間)に米国科学誌「Developmental Cell」(オンライン)に掲載されました。
タイトル:“The oncogenic PRL protein causes acid addiction of cells by stimulating lysosomal exocytosis”
著者名:Yosuke Funato, Atsushi Yoshida, Yusuke Hirata, Osamu Hashizume, Daisuke Yamazaki, and Hiroaki Miki
なお、本研究は科学研究費補助⾦、上原記念生命科学財団、SGH財団の支援を受け、また東北大学大学院薬学研究科 平田祐介博士の協力を得て行われました。
※1 リソソーム
細胞内小器官(細胞の中にある、さまざまな役割に特化した部位)の一つで、プロトン(H+)を内部に蓄え酸性化していることが特徴。主要な役割の一つとして不要物の分解があり、オートファゴソームと融合してオートリソソームを形成し、細胞内の不要物を分解するオートファジー(大隅良典博士による2016年ノーベル生理学・医学賞の受賞対象研究)を行う際にも用いられる。