生体防御研究部門 免疫化学分野/荒瀬研究室
我々の免疫系は感染症から体を守るための生体防御機構であり、宿主の免疫系から逃れようとする病原体との攻防により進化してきました。一方、病原体を攻撃するための免疫機構の異常によって自己免疫疾患やアレルギー疾患等の様々な疾患が生じます。
免疫化学研究分野では、免疫系の機能分子と病原体との相互作用の解明を通じて、なぜ自己免疫疾患が発症したり感染症が重症化したりする分子機構の解明を行なっています。
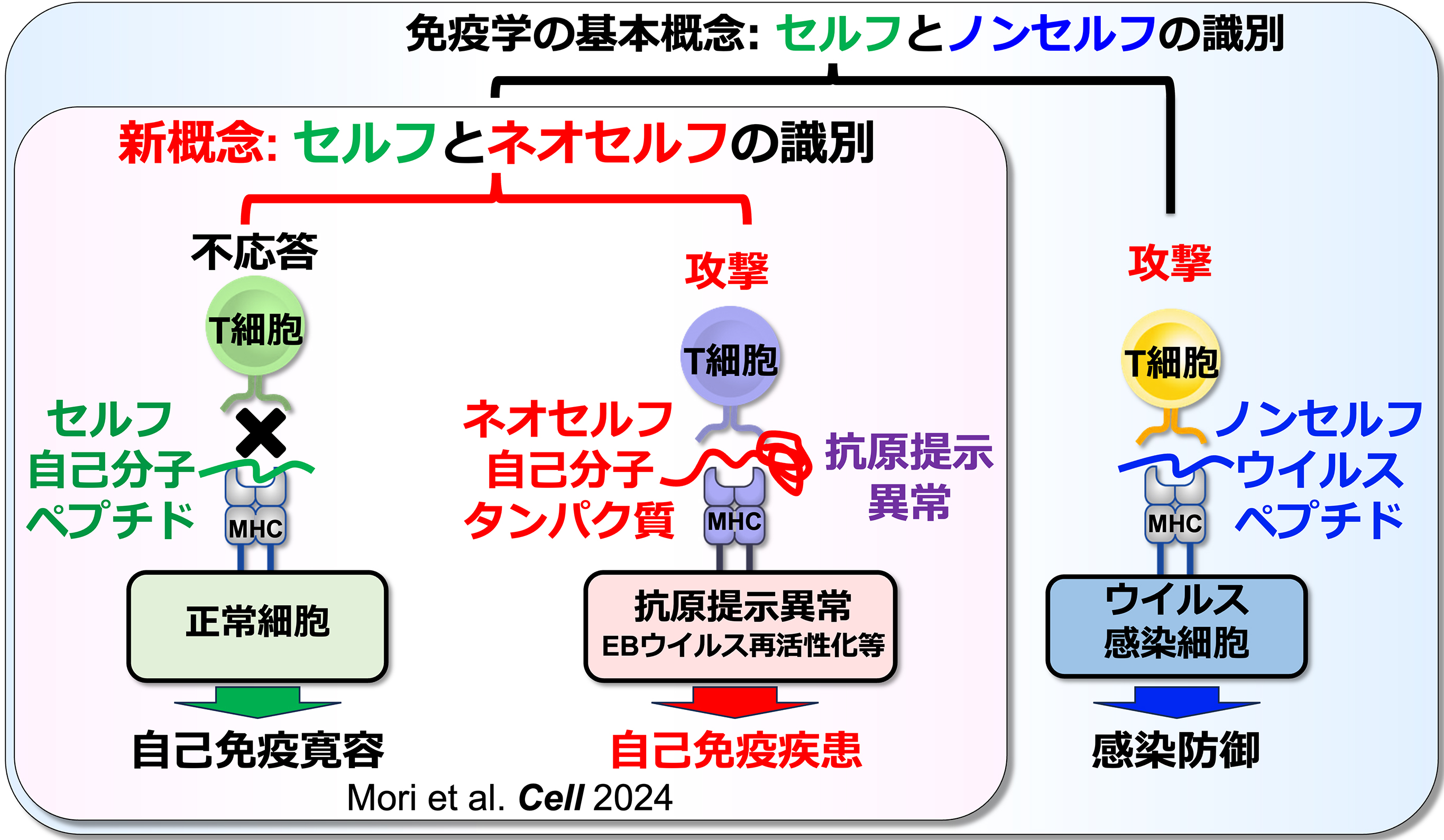
ネオセルフと自己免疫疾患
免疫学において、MHCクラスII分子はT細胞にペプチドを提示する役割を担うと考えられてきました。しかし、MHCクラスII分子によるペプチド提示に必須のインバリアント鎖の発現が低下すると、細胞内で異常な立体構造を持つ「ミスフォールドタンパク質」がMHCクラスII分子に提示されるようになります。我々は、このように通常は提示されない自己抗原を「ネオセルフ」と名付けました。我々の研究により、T細胞が正常に提示された自己ペプチド(セルフ)と、異常に提示されたネオセルフを識別すること、そしてネオセルフに対する免疫応答が自己免疫疾患を引き起こすことが明らかになりました(図1)。事実、全身性自己免疫疾患である全身性エリテマトーデス(SLE)の患者において、異常に活性化しているT細胞の約10%がネオセルフを認識します。一方、ほとんどの成人はEBウイルスに持続感染しており、ウイルスの再活性化頻度が高いとSLEの発症リスクが高まることが知られています。我々は、繰り返されるEBウイルスの再活性化がMHCの機能異常を誘発し、その結果生じたネオセルフがSLE患者の自己応答性T細胞を活性化させるというメカニズムを突き止めました。これは、持続感染ウイルスの再活性化が自己免疫疾患の発症につながる機構を世界で初めて解明したものです。本研究室では、このように従来の免疫学の概念を覆す「T細胞によるセルフとネオセルフの識別」という新たな免疫認識機構を基盤に、様々な未解明の免疫現象に取り組んでいます。そして、自己免疫疾患の根本原因を解明し、その原因自体を標的とした新たな治療法の開発を目指しております。
感染症の重症化機構の解明
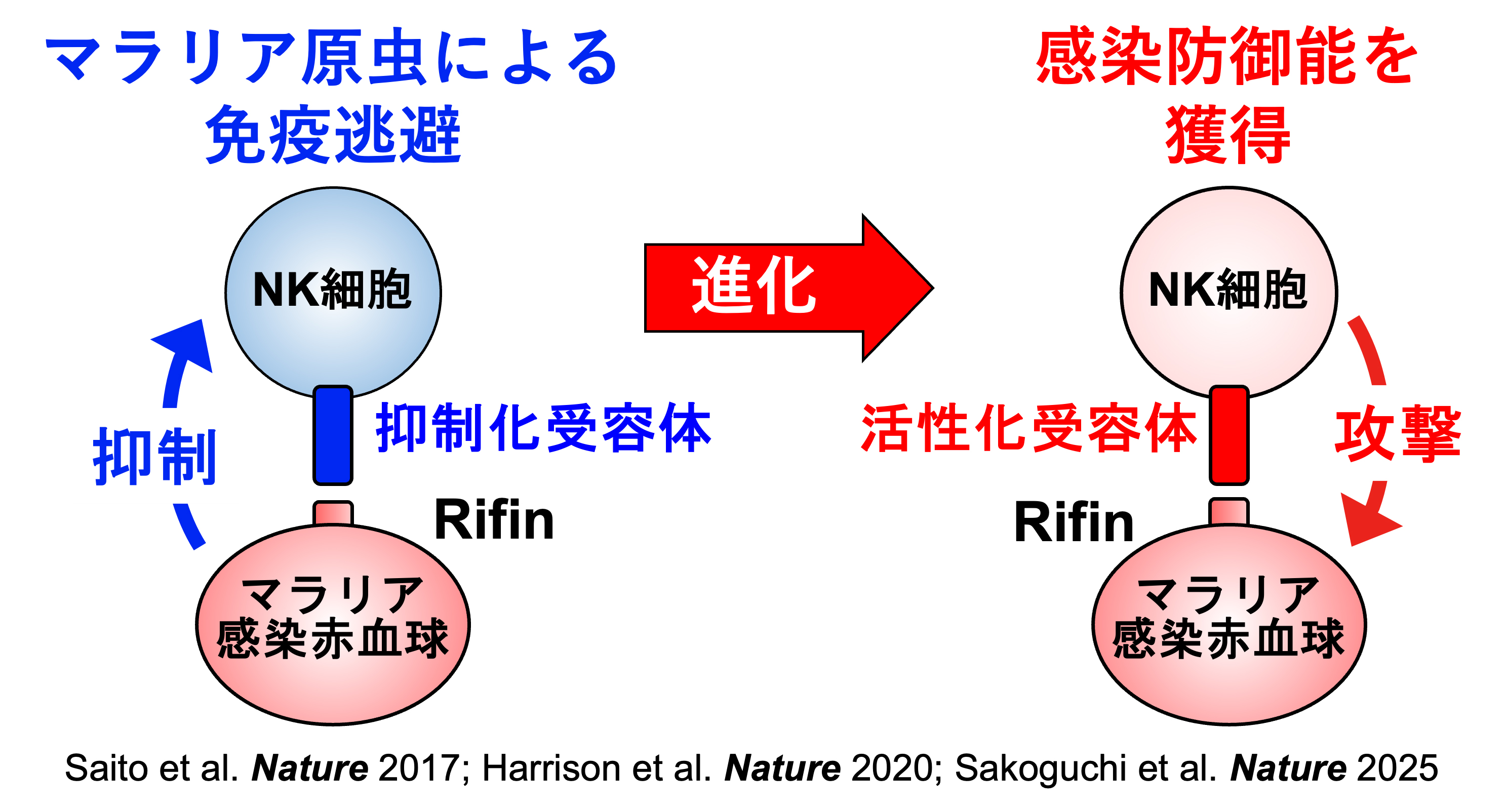
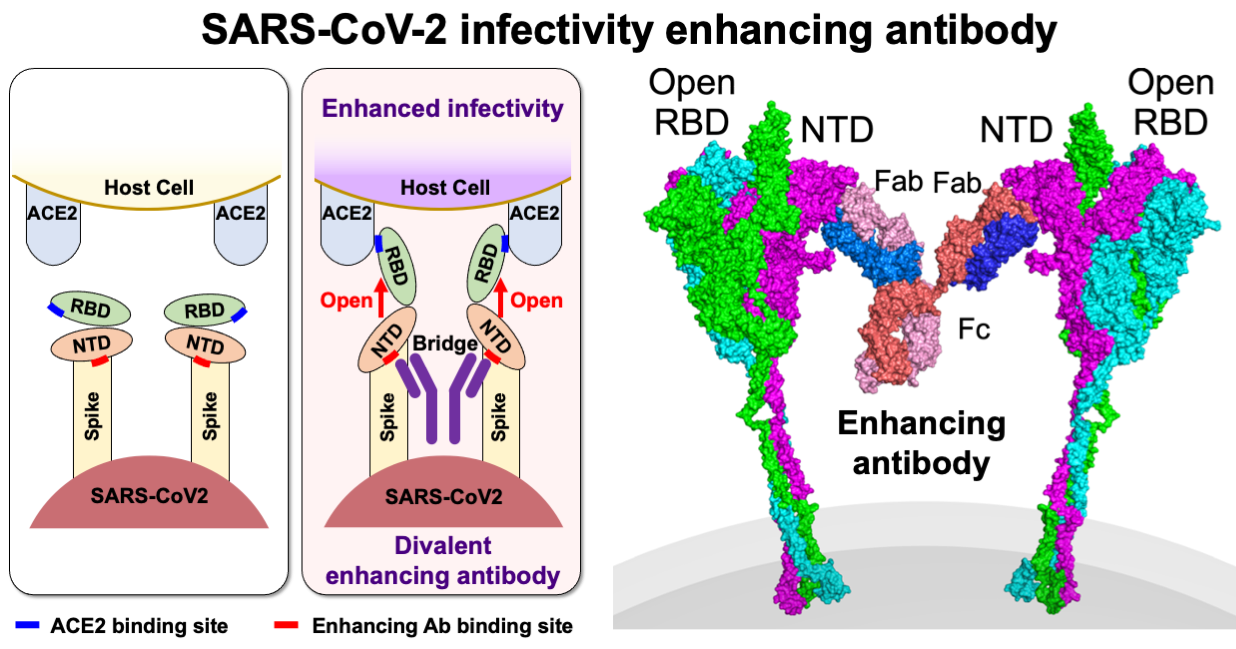
同じ病原体に感染しても、軽い症状しか見られない人がいる一方、重症化する人もいます。従って、感染症による重症化機構の解明は、感染症対策としても非常に重要になります。免疫細胞は、抑制化レセプターと活性化レセプターという相反する機能のレセプターがペアになっているペア型レセプターを発現しています。抑制化レセプターはMHC分子などの自己分子を認識し、自己成分を攻撃することがないよう免疫反応を抑制します。病原微生物はこれを利用して、MHC様分子等を発現して宿主の免疫系を抑制し、宿主内で生き残る術を獲得しました。一方、活性化レセプターは抑制化レセプターと構造は酷似していますが、自己分子の認識はせず、その機能についての多くは不明でした。免疫化学研究分野では、この活性化レセプターが、ウイルスのニセMHC分子を認識したり、細菌プロテアーゼによって分解された抗体を認識したりして免疫反応を誘導することを見出しました。これは抑制化レセプターを利用して免疫反応を抑制する病原微生物に抵抗するために宿主側が獲得した対抗戦術と考えられます。これらのペア型レセプターには個人差があるため、これらの受容体と病原体の相互作用が重症化に関与していると考えられます(図2)。また、新型コロナウイルス感染症のように成人になってから感染すると重症化しやすい感染症や逆に子供の方が重症化しやすい感染症がありますが、そのメカニズムは明らかでありません。新型コロナウイルス感染症に関しては、これまで感染防御に関与していると考えられてきた抗体の中に、逆に感染性を高める抗体も存在することを発見しました(図3)。このように当研究室では、ペア型受容体や病原体に対する免疫応答等がどのように感染症の重症化に関与しているかについて様々な角度から研究を行なっております。これらの研究により、感染症による重症化予防ばかりでなく効果的なワクチン開発に貢献できると考えております。
-
図1:T細胞によるセルフとネオセルフの識別能と自己免疫疾患
同じ自己抗原由来でもMHCクラスII分子に正常に提示されたペプチド抗原と異常に提示されたネオセルフ抗原をT細胞が識別する。さらに、ネオセルフ抗原に対する免疫応答が自己免疫疾患を引き起こす(Mori et al. Cell 2024)。T細胞によるネオセルフ抗原の認識はこれまでの免疫学の概念を覆す発見であり、T細胞によるネオセルフの認識は様々な免疫応答に関与していると考えられる。 -
図2:ペア型受容体と熱帯熱マラリアとの共進化機構
抑制性受容体は免疫応答の制御において重要な機能を担う一方、病原体はこれを利用した免疫逃避機構を進化させてきました。本研究室では、熱帯熱マラリア原虫がこの抑制性受容体を利用して免疫応答を回避する分子メカニズムを解明しました (Saito et al. Nature 2017; Harrison et al. Nature 2020)。さらに、これに対抗するように、ヒトは抑制性受容体から進化した活性化受容体を獲得し、マラリアへの抵抗性を身につけたことも明らかにしました (Sakoguchi et al. Nature 2025)。 -
図3:新型コロナウイルスに対する感染増強抗体 これまで、ウイルスに対する抗体は中和抗体として感染防御に重要な機能を担っていると考えられてきた。しかし、新型コロナウイルスに感染した患者さん由来の抗体を解析することにより、ウイルスに対する抗体の中には、ウイルス分子の構造を変化させ感染性を高める抗体も存在することが判明した。従って、ウイルスに対する抗体応答を検討する場合は、これらの感染性を高める抗体の影響を検討する必要がある (Liu et al. Cell 2021)。
メンバー
- 教授: 荒瀬 尚(兼)
- 准教授: 金 暉
- 助教: 森 俊輔
- 助教: 中井 渉(兼)
ホームページ
最近の代表的な論文
(1) RIFINs displayed on malaria-infected erythrocytes bind KIR2DL1 and KIR2DS1. Sakoguchi et al., Nature (2025).
(2) Neoself-antigens are the primary target for autoreactive T cells in human lupus. Mori et al., Cell (2024) 187: 6071-6087.
(3) An infectivity-enhancing site on the SARS-CoV-2 spike protein targeted by antibodies. Liu et al., Cell (2021) 184:3452-3466.
(4) Immune evasion of Plasmodium falciparum by RIFIN via inhibitory receptors. Saito F., et al., Nature (2017) 552:101–105.
(5) PILRα is a herpes simplex virus-1 entry co-receptor that associates with glycoprotein B. Satoh T., et al., Cell (2008) 132:935-44.