感染症国際研究センター 病原細菌研究グループ/阿部研究室
研究内容
世界中に蔓延する抗菌薬耐性菌の増加スピードは驚異的であり、2050年には薬剤耐性菌による死者数が悪性腫瘍による死者数を上回る可能性も示唆されています。抗菌薬の使用自体が抗菌薬耐性を生み出す直接的な原因であることは疑いようがありませんが、現在の臨床現場においては細菌感染を適切に診断し、適切に抗菌薬を使用することは実はまだ容易ではありません。私たちは病原細菌とそれに対する宿主免疫、さらには抗菌薬の相互関係について解析し、より良い診断法や治療指針の提案に寄与できることを目指しています。
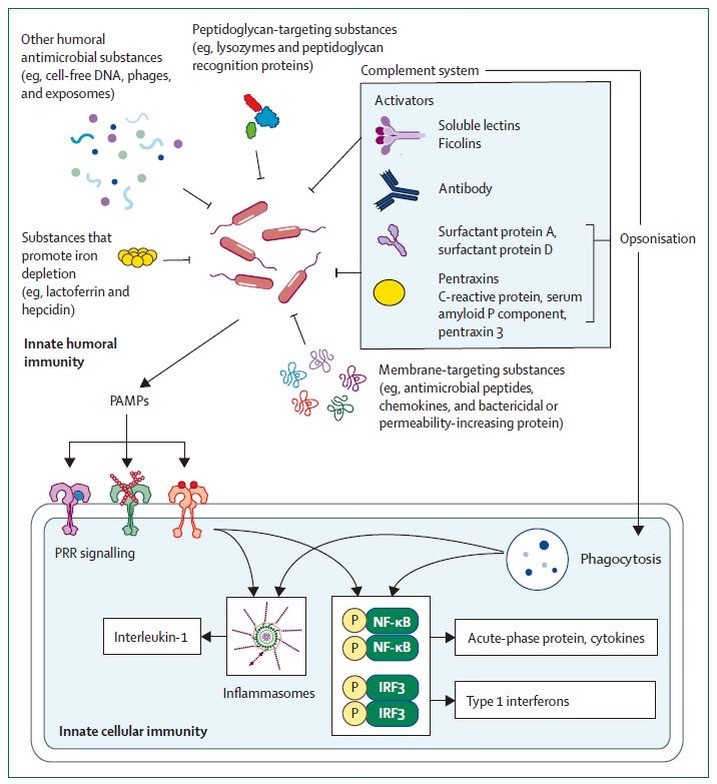
病原菌と液性殺菌因子の個体差
細菌性の血流感染は細菌と宿主免疫間の複雑な相互反応の結果生じており、細菌と宿主免疫の組み合わせ次第で多彩な転機を辿ります。例えば、健常人においても常在フローラ中の細菌が機に乗じて血流に入り込んでいることが知られていますが、これらの侵入細菌は瞬時に自然免疫系によって排除・殺菌されるため、通常は病原性を発揮することはありません。ところが、細菌側因子と宿主側因子の個体差次第では、致死率の高い血流感染症を引き起こす可能性もあるのです。細胞性免疫が作動する前段階に病原体と液性免疫がどのように関わるのか、また病原菌及び宿主液性免疫の個体差が生じる要因やその臨床上の影響について研究します。
病原菌、宿主免疫、抗菌薬の相互関係性
現在臨床現場では、抗菌薬を添加した人工栄養培地における菌の発育抑制効果に基づいて抗菌薬選択が行われており、宿主因子を考慮した手法は取られていません。宿主因子、病原菌、抗菌薬という3つの因子を包括した、従来とは異なる薬剤感受性試験を将来的に提示することを目標としています。
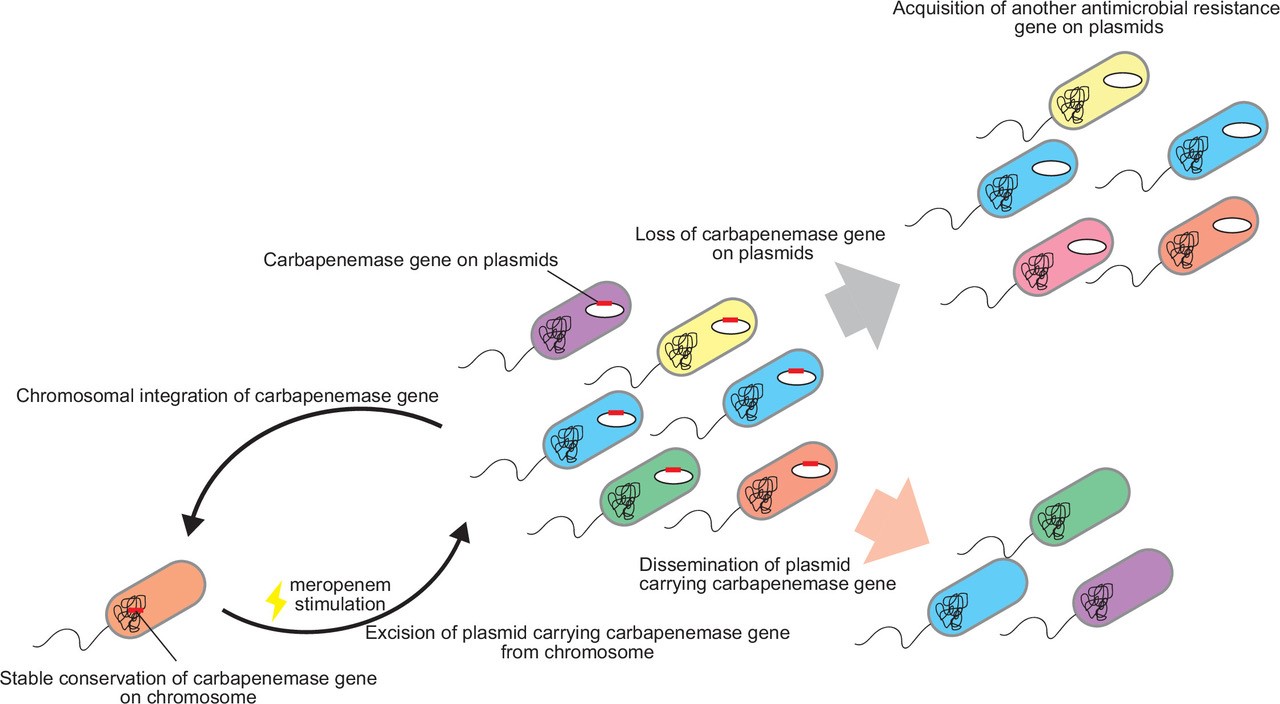
タイにおけるカルバペネム耐性菌拡散模様
当研究室は日本タイ感染症共同研究センターの薬剤耐性菌部門と共に研究を行なっています。タイで収集されたカルバペネム耐性菌とそのゲノム解析結果を用いて、その拡散メカニズムや耐性メカニズム、病原因子について研究します。
メンバー
- 特任講師: 阿部 隆一郎
- 特任助教: Noha M. Elhosseiny
- 特任研究員: 李 峰宇
ホームページ
最近の代表的な論文
(1) Re-visiting humoral constitutive antibacterial heterogeneity in bloodstream infections. Abe R, et al., Lancet Infect Dis. (2023) 6:S1473-3099(23)00494-2.
(2) Carbapenem triggers dissemination of chromosomally integrated carbapenemase genes via conjugative plasmids in Escherichia coli. Abe R, et al., mSystems. (2023) 8:e0127522.
(3) Population analysis profiling: is it still the gold standard for the determination of heteroresistance in carbapenemase-producing Enterobacteriaceae? Abe R, et al., Int J Antimicrob Agents. (2022) 60:106644.
(4) A nationwide plasmidome surveillance in Thailand reveals a limited variety of New Delhi metallo-β-lactamase-producing carbapenem-resistant Enterobacteriaceae clones and spreading plasmids. Abe R, et al., J Clin Microbiol. (2022) 60:e0108022.
(5) Enhanced carbapenem resistance through multimerization of plasmids carrying carbapenemase genes. Abe R, et al., mBio. (2021) 12:e0018621.
(6) Characterization of the plasmidome encoding carbapenemase and mechanisms for dissemination of carbapenem-resistant Enterobacteriaceae. Abe R, et al., mSystems. (2020) 5:e00759-20.