難治感染症対策研究センター 分子原虫学分野/岩永研究室
マラリアは蚊媒介性の原虫感染症であり、年間約2億人の感染者と約45万人の死者を出す世界三大感染症の一つです。病原体であるマラリア原虫はヒト−媒介蚊の間で形態変化を伴いながら、宿主細胞へ侵入・寄生し、増殖しながら生活環を完結します。その分子基盤の解明は原虫の生物学的理解を深めるだけでなく、薬剤・ワクチンの標的分子・抗原の同定へと繋がります。我々は次世代シークエンサー・CRISPR/Cas9 system・人工染色体技術などの最新のゲノム解析技術・組換えDNA技術を駆使し、分子生物学・合成生物学的なアプローチで原虫生活環の分子基盤の全貌解明を進めています。
- マラリア原虫の転写制御メカニズムの解明:AP2転写因子研究
マラリア原虫は蚊の吸血後、宿主動物の肝臓の細胞に感染・寄生後、血中へと放出され、赤血球に感染します。赤血球内では無性的に増殖し、赤血球への感染を繰り返し、特有の症状を引き起こします。無性増殖期の一部の原虫は増殖を停止し、雌雄の生殖母体へと分化します。吸血により再び、媒介蚊体内に移行した時、生殖母体細胞だけが生き残り、雌雄の生殖体へと分化・受精します。その後、分化した原虫は蚊中腸へと侵入・寄生・増殖します。最終的に中腸で増殖した原虫は蚊唾液腺へと移動し、次の吸血の機会を待ちます(参考:米国CDC, https://www.cdc.gov/malaria/about/biology/index.html)。マラリア原虫は各生育ステージで特異的な遺伝子を発現しながら、この複雑な生活環を成立させています。つまり、転写制御は生活環の根幹を成すものです。我々の研究室では世界に先駆け、マラリア原虫の配列特異的転写因子(Apetala2, AP2, 27種)ファミリーを同定しました。更に各転写因子がステージ特異的に発現し、各生育ステージでは一個のマスター転写因子がステージ形成に関わる全遺伝子を直接かつ包括的に制御することを明らかとしました。現在、全てのマスター転写因子の標的分子を次世代シークエンサーを用いた技術により同定し、これをもとに原虫の全生活環における転写制御メカニズム解明を進めています。
- マラリア原虫の人工染色体から人工細胞作製まで:原虫の合成生物学的研究
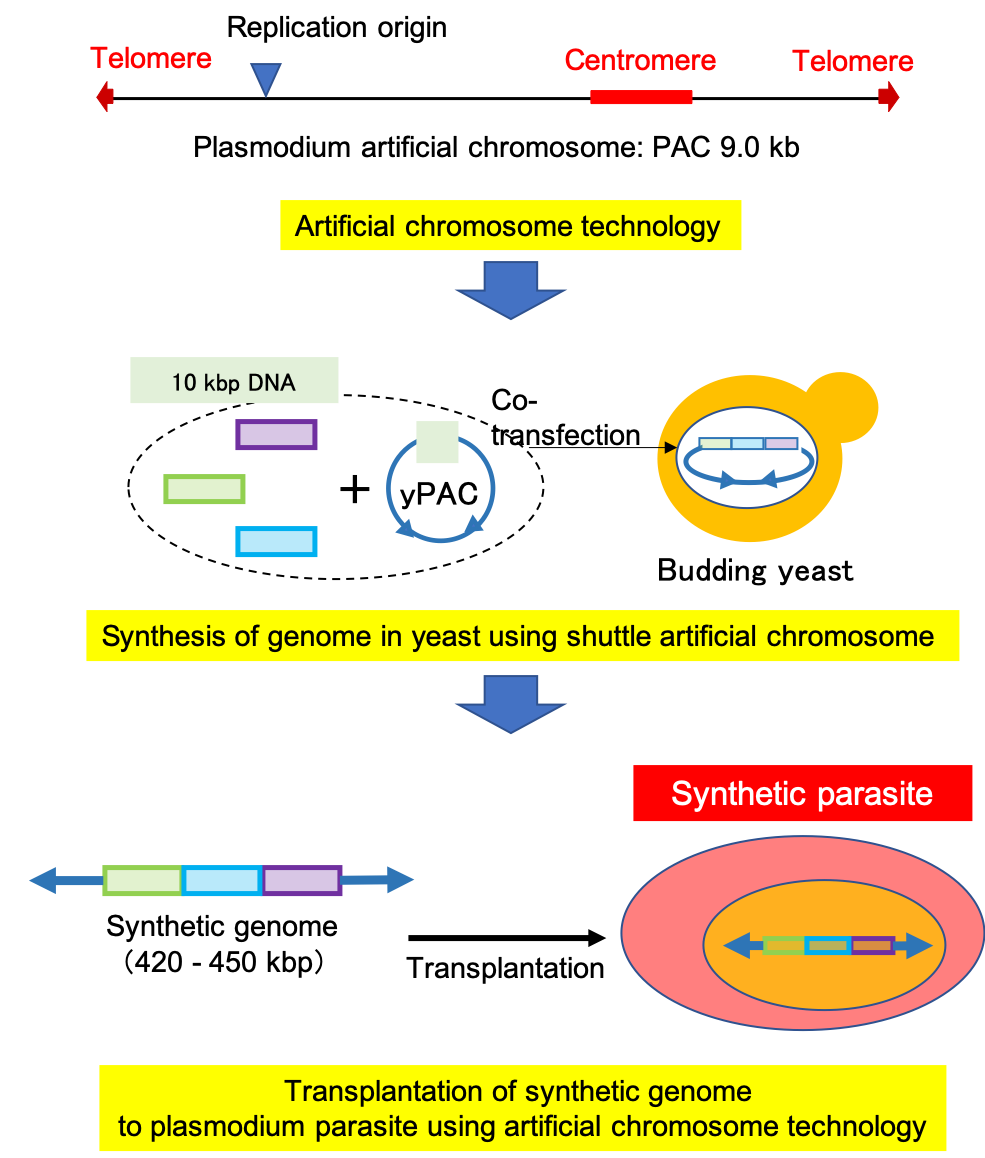
人工染色体とは染色体分配に必須なセントロメア、直鎖状染色体の末端保護に必須なテロメア、複製に必須な複製開始起点の三要素を組み合わせた極小の染色体です。我々はマラリア原虫のゲノムプロジェクトの終了後、決定された配列情報を解析し、各染色体上のセントロメアを同定しました。更にこれにテロメアと複製開始起点を組み合わせ、マラリア原虫人工染色体(Plasmodium Artificial Chromosome, PAC, 9.0 kbp)の開発に成功しました。これは出芽酵母人工染色体(Yeast Artificial Chromosome, YAC)に続く世界第二例目のものです。PACは原虫内で完全に本来の染色体様に挙動し、その染色体機能の完全性は前述のYACを超えるものであり、PACの大きな特徴の一つです。我々の研究室ではPACの開発成功を応用し、人工合成した巨大ゲノムをPACの中に組み込み、マラリア原虫へゲノム移植して、人工合成マラリア原虫の作出することを試みています。人工合成マラリア原虫は世界初の人工真核生物となり、合成生物学を新たな段階へと導きます。この技術は人工弱毒化マラリア原虫の作出や、薬剤耐性研究モデル原虫の作出などへの応用が考えられ、マラリア対策に貢献すると期待されます。
メンバー
- 教授: 岩永 史朗
- 講師: 西 翔
ホームページ
最近の代表的な論文
(1) Immune evasion runs in the family: two surface protein families of Plasmodium falciparum-infected erythrocytes. Chamberlain SG. et al., CurrOpin Microbiol. (2025) doi: 10.1016/j.mib.2025.102598
(2) PbARID-associated chromatin remodeling events are essential for gametocyte development in Plasmodium. Nishi T. et al., Nucleic Acids Res. (2024) 10.1093/nar/gkae207
(3) Differentiation of Plasmodium male gametocytes is initiated by the recruitment of a chromatin remodeler to a male-specific cis-element. Kaneko I. et al., Proc Natl Acad Sci U S A. (2023) 10.1073/pnas.2303432120
(4) Genome-wide functional screening of drug-resistance genes in Plasmodium falciparum. Iwanaga S. et al, Nat Commun. (2022) 10.1038/s41467-022-33804-w