難治感染症対策研究センター マラリアワクチン開発研究グループ/堀井研究室
熱帯熱マラリアは世界で2.6億人以上が感染し年間死者数は66万人にものぼる感染症です。マラリアワクチン開発寄附研究部門では、効果の高いマラリアワクチンの実用化に向けた開発を行うとともに、ワクチンの基盤となる抗原遺伝子の分子機構解析を行い、得られた知見をワクチン開発の現場に活かすべく研究を展開しています。
SERA5を標的としたマラリアワクチン開発
熱帯熱マラリアに対する治療は主に抗マラリア薬により行われていますが、薬剤耐性株の蔓延などが大きな問題となっています。その対策として効果的なワクチン開発が急がれていますが、ワクチンの抗原となる候補分子に見られる極度の遺伝子多型などの問題から実用化されたワクチンはまだありません。
研究室では、遺伝子多型のほとんど見られない熱帯熱マラリア原虫のSERA5抗原分子に着目し、組換えSE36タンパク質をもとにSE36マラリアワクチン(NPC-SE36ワクチン)の開発を行っています。SE36タンパク質は、赤血球に侵入し増殖したマラリア原虫が、赤血球を破壊して出てくる際に原虫の表面に存在するタンパク質です。
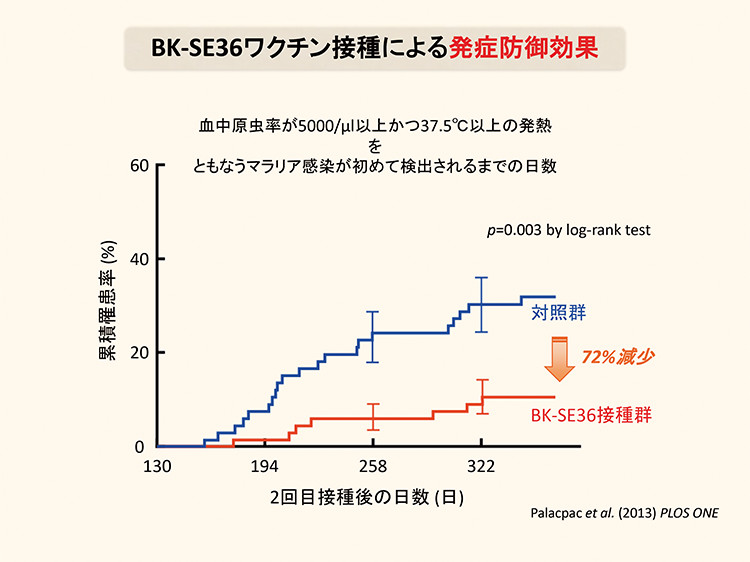
NPC-SE36ワクチン臨床試験において、マラリアに感染したことのない日本人はワクチンに対する高い免疫応答を示したものの、流行地域では感染歴のあるウガンダ成人にはほとんど反応が見られませんでした。流行地域では度重なるマラリア感染によりSE36に対する免疫寛容が生じているためです。しかし、マラリア感染歴の少ない6-20歳の若年層では免疫応答が認められ、 1年間の追跡調査の結果 72%の発症防御効果を確認しました(図2)。マラリアによる死者は5歳以下の幼児が中心であることから、2015年より西アフリカのブルキナファソにおいて1-5歳の子供を対象に臨床試験を実施し、幼児における安全性と、1歳児では日本人と同様に高い免疫応答を示すことを確認しました。また、2018年より自然免疫を刺激するCpG アジュバントを加えた新たなワクチンの臨床試験をブルキナファソにおいて実施し、その安全性と高い免疫原性及び74%のマラリア発症防御効果を確認しました(図3)。今後の治験で、さらに有効性を明らかにしてゆく予定です。
マラリアの寄生戦略とSE36抗原タンパク質の機能
マラリア原虫は宿主の免疫回避のための戦略を高度に発達させています。ある抗原に対するワクチンにより防御免疫を成立させても、それに反応しない型の抗原遺伝子を持つ原虫が存在するという遺伝子多型もその戦略一つであり、これがワクチン開発を困難にする主な要因になっています。これに対しSERA5 は、流行地域の人たちでは度重なるマラリア感染による免疫寛容により抗体が作られにくく、またその結果、遺伝子多型が少ないことがワクチン抗原として極めて有利な特徴です 。最新の研究成果として、ワクチン抗原であるSE36 タンパク質はマラリア原虫メロゾイト細胞の表面を覆い、宿主の細胞接着分子であるヴィトロネクチンがこれに結合、さらにヴィトロネクチンに30 種以上の宿主タンパク質が結合して原虫表面を宿主タンパク質でカモフラージュしていることを明らかにしました。また、SE36タンパク質とヴィトロネクチン複合体が宿主の免疫系に提示されることにより徐々に免疫寛容が生じると考えています。
マラリアワクチン開発詳細について
-
図1:NPC-SE36マラリアワクチン治験製剤 臨床治験用の製剤は(財)阪大微生物病研究会の協力のもと、GMP条件を遵守して生産された。 (2018年より、BK-SE36マラリアワクチンはNPC-SE36マラリアワクチンへとコードネームを変更した。)
-
図2:NPC-SE36マラリアワクチン接種による発症防御効果 NPC-SE36マラリアワクチンを接種した被験者群(66名)と、マラリアワクチンを接種していない対照群(66名)について1年間の追跡調査を行った。その結果、マラリアワクチンを接種した被験者群ではマラリア発症の累積数が対照群に比べて少なく、防御効果は72%であった。 Palacpac et al., Plos ONE. 2013; 8(5): e64073
-
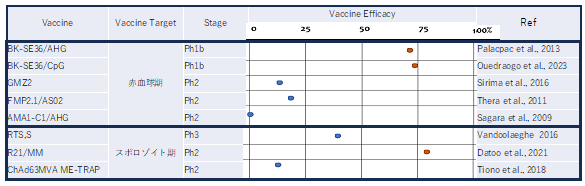
図3:全世界においてこれまでに報告されている主要なマラリアワクチン候補の防御効果の比較
SE36以外の赤血球期ワクチンの防御効果が低いのは使用している抗原遺伝子の多型が高いためである。スポロゾイト期ワクチンのRTS,SとR21はWHOの認証を受けている。しかしSE36ワクチンとは異なり毎年の追加接種が必要である。
メンバー
- 室長:飯田 哲也教授(兼)
- 特任教授:堀井 俊宏
- 特任教授:PALACPAC NIRIANNE MARIE QUERIJERO
ホームページ
最近の代表的な論文
(1)Persistence of Anti-SE36 Antibodies Induced by the Malaria Vaccine Candidate BK-SE36/CpG in 5-10-Year-Old Burkinabe Children Naturally Exposed to Malaria. Nebie I, et al., Vaccines (Basel). (2024) 12(2):166.
(2)Safety and immunogenicity of BK-SE36/CpG malaria vaccine in healthy Burkinabe adults and children: a phase 1b randomised, controlled, double-blinded, age de-escalation trial. Ouédraogo A, et al., Front Immunol. (2023) 14:1267372.
(3)Plasmodium falciparum infection coinciding with the malaria vaccine candidate BK-SE36 administration interferes with the immune responses in Burkinabe children. Tiono AB, et al., Front Immunol. (2023) 14:1119820.
(4)African-specific polymorphisms in Plasmodium falciparum serine repeat antigen 5 in Uganda and Burkina Faso clinical samples do not interfere with antibody response to BK-SE36 vaccination. Arisue N et al., Front Cell Infect Microbiol. (2022) 12:1058081.
(5)Safety and immunogenicity of BK-SE36 in a blinded, randomized, controlled, age de-escalating phase Ib clinical trial in Burkinabe children. Bougouma EC, et al., Front Immunol. (2022) 13:978591.
(6)First-in-human randomized trial and follow-up study of Plasmodium falciparum blood-stage malaria vaccine BK-SE36 with CpG-ODN(K3). Ezoe S, et al., Vaccine. (2020)
(7)The malaria parasite Plasmodium falciparum in red blood cells selectively takes up serum proteins that affect host pathogenicity. Tougan T, et al., Malar J. (2020) 19(1):155.
(8)Molecular Camouflage of Plasmodium falciparum Merozoites by Binding of Host Vitronectin to P47 Fragment of SERA5. Tougan T, et al., Sci Rep. (2018) 8(1):5052.
(9)Antibody titres and boosting after natural malaria infection in BK-SE36 vaccine responders during a follow-up study in Uganda. Yagi M, et al., Sci Rep. (2016) 6:34363.
(10)Protective Epitopes of the Plasmodium falciparum SERA5 Malaria Vaccine Reside in Intrinsically Unstructured N-Terminal Repetitive Sequences. Yagi M, et al., PLoS One. (2014) 9(6):e98460.