感染症国際研究センター 新興ウイルス感染症研究グループ/岩﨑研究室
新興ウイルス感染症研究
SARSコロナウイルス2型(SARS-CoV-2)が引き起こす呼吸器感染症(COVID-19)のパンデミックにより、新興ウイルス感染症研究の重要性がこれまでになく高まっています。世界にはSARS-CoV-2以外にも、人類にとって大きな脅威であるにもかかわらず、あまり研究が進んでいないウイルスがいくつか存在します。我々はそのような新興ウイルスの中でも、特に致死率が高く、確立された治療法や予防法のないラッサウイルスを中心に研究に取り組んでいます。ラッサウイルスが引き起こす致死的な出血熱症であるラッサ熱は、ワクチン開発を支援する国際機関CEPI(Coalition for Epidemic Preparedness Innovations)が指定する8つのPriority Diseasesの一つに含まれるなど、ラッサウイルス研究開発は世界的な注目を集めています。我々は、最先端のウイルス学、免疫学、分子生物学、RNA生物学、バイオインフォマティクス、ケミカルバイオロジーの分析技術を駆使し、様々な視点から「ウイルス増殖メカニズム」及び「ウイルスが病気を起こすメカニズム」の解明を目指しています。また、得られた知見を活用した、新規検査法・治療法・予防法開発の応用研究に取り組んでいます。
進行中のプロジェクト
– ポリA非依存的翻訳制御
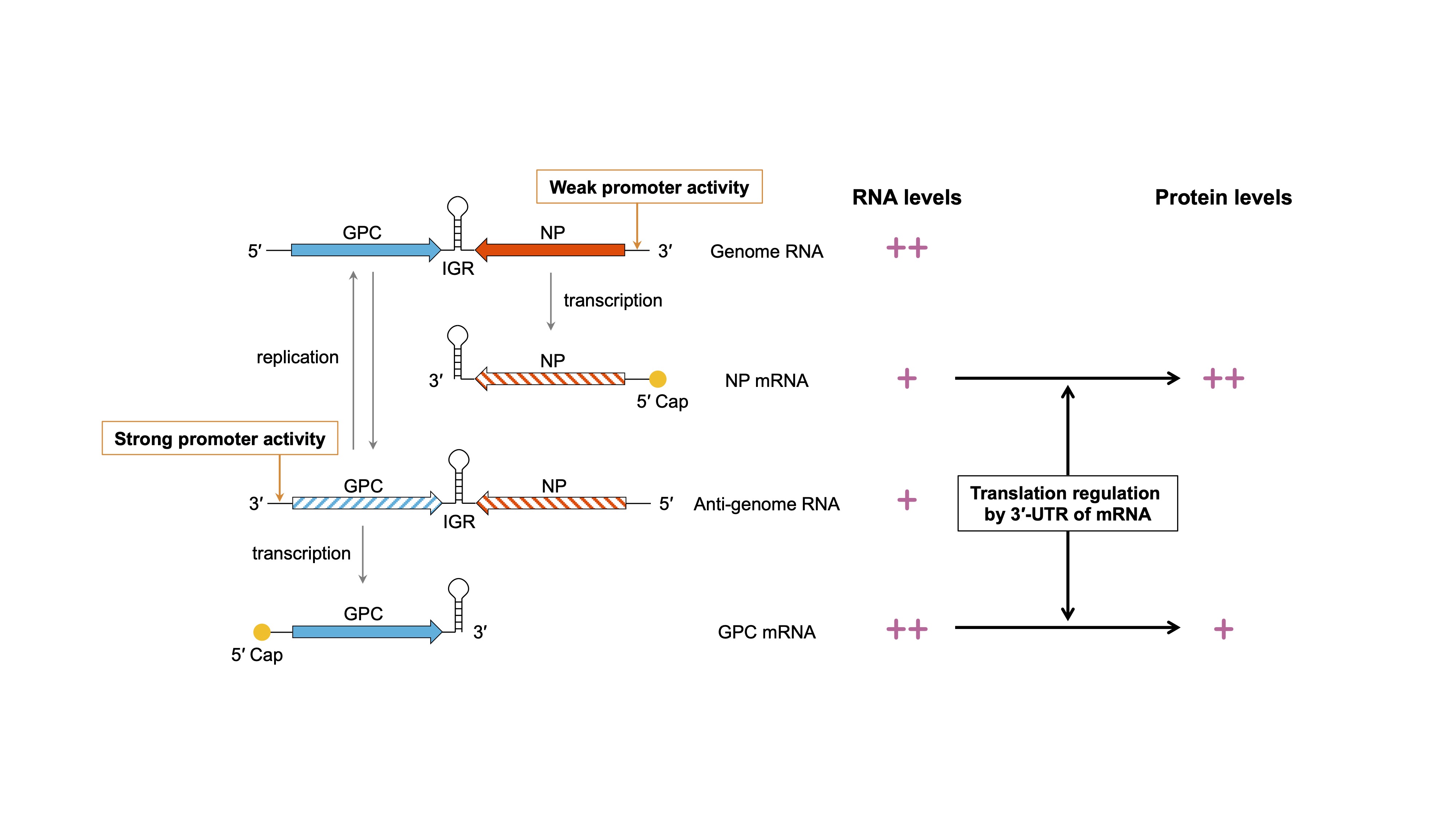
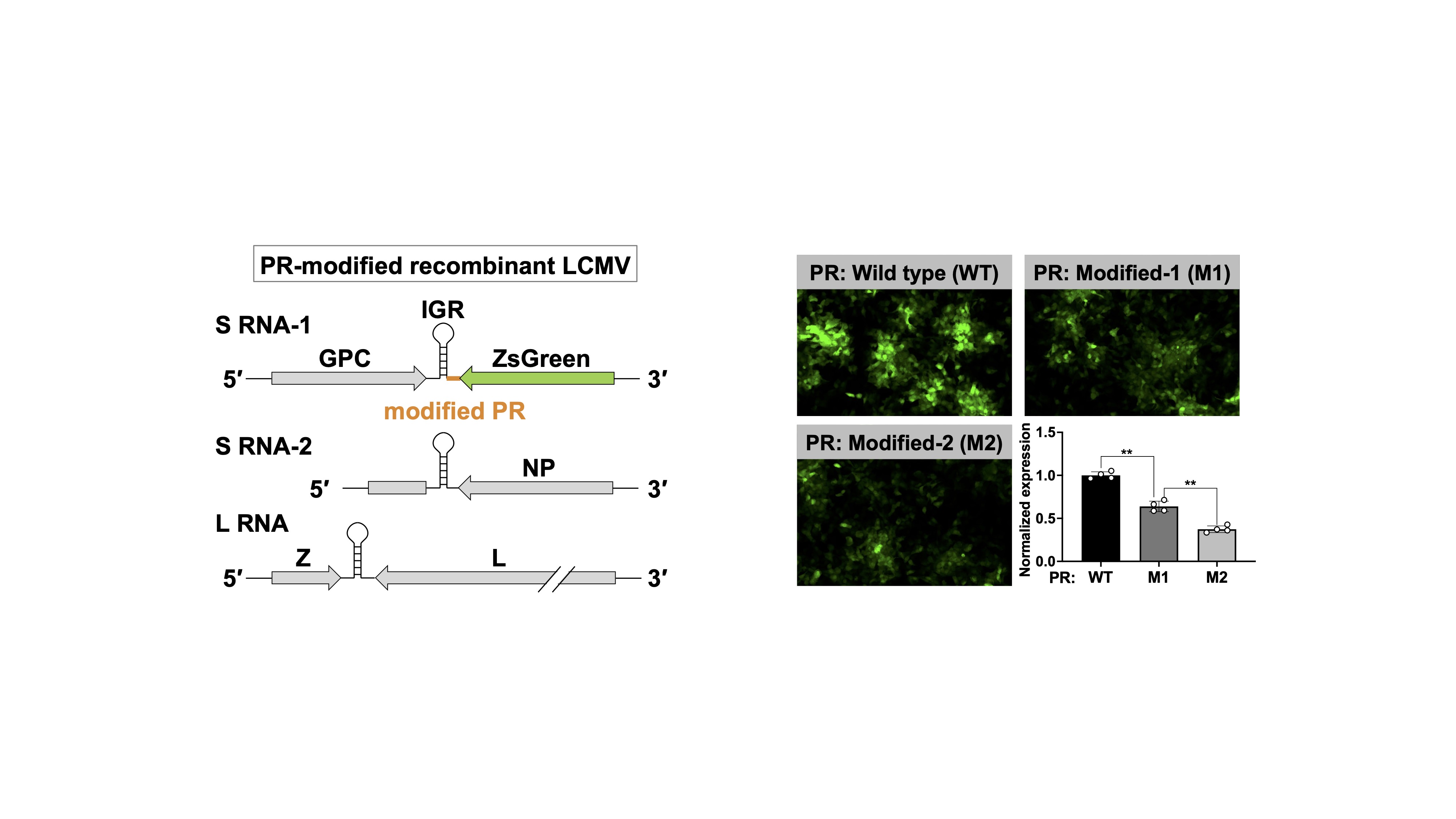
ラッサウイルスを含むアレナウイルス科のウイルスが産生するmRNA(vmRNA)には、3'末端にポリAが付加されない特徴があります。我々は、ポリAのない3'-UTRがvmRNAの翻訳効率を制御することを発見し、これがアンビセンスと呼ばれる特殊なコード様式を成立させる重要な機構であることを見出しました(図1)。この発見を基に、ウイルスタンパク質発現バランスを破綻させたラッサウイルス弱毒生ワクチン開発に取り組んできました。さらに、翻訳制御に特に重要な領域(proximal region, PR)を特定し、外来遺伝子発現量を自在に調節できる新規アレナウイルスベクター開発のための分子基盤を構築しました(図2)。現在は、RNA生物学的手法を用いたポリA非依存的翻訳制御機構のより詳細な解明に取り組んでいます。
– 宿主因子
ウイルスは核酸、脂質、タンパク質といった限られた自身の構成要素のみでは自己複製することはできず、増殖には宿主細胞機構を必要とします。我々は、リバースジェネティクス系やCRISPR-Cas9システムをベースとした遺伝子工学の手法を駆使し、ウイルス・宿主の両面からラッサウイルス増殖に寄与する宿主因子の同定並びにそれらの機能解析に取り組んでいます。また、ラッサウイルスが利用する宿主因子を理解することで、新たなウイルス増殖分子機構の解明や、宿主因子を標的とした新規治療法開発につながることが期待されます。
– 抗ウイルス薬
ラッサウイルスはその病原性の高さから、感染性粒子の取り扱いには最高レベルの封じ込め施設(biosafety level 4, BSL4)が必要であり、このことがラッサウイルス研究開発を妨げる主要な原因になっています。我々は、ラッサウイルスの転写複製活性をレポーター遺伝子の発現量で評価するミニゲノムアッセイを応用した、ウイルスフリーの化合物スクリーニングに取り組んでいます。これまでにラッサウイルス転写複製を強く抑制する化合物を複数同定しました。現在はより詳細な作用機序の解明や、有機合成化学の専門家らとともに、構造活性相関を基にしたより強力なラッサウイルス阻害剤の取得に取り組んでいます。
– ワクチン
ラッサウイルスのコントロールには、ウイルス特異的な細胞傷害性T細胞(CTL)応答が重要であることが知られています。そのためこれまでは、1回の接種で長期間の細胞性及び液性免疫を誘導できる弱毒生ワクチンがラッサウイルスワクチン研究開発の中心でした。一方、パンデミックを引き起こしたCOVID-19に対して、SARS-CoV-2のレセプター認識スパイクタンパク質(SARS2-S)を発現するmRNAワクチンが世界的に用いられました。非常に興味深いことに、SARS2-S発現mRNAワクチンは、SARS2-Sに対する抗体だけでなく、SARS2-S特異的なCTLも誘導することが明らかになっています。そこで我々は、細胞性免疫の誘導がウイルスのコントロールに重要なラッサウイルスに対しても、mRNAワクチンが有効なモダリティとなると考え、新規ラッサウイルスmRNAワクチンの研究開発に取り組んでいます。
– LCMVマウスモデル
ヒトに病気を引き起こすウイルスの多くは実験室マウスにあまり感染しません。一方、ラッサウイルスと近縁で、実験室マウスと同じMus musculusを自然宿主とするリンパ球性脈絡髄膜炎ウイルス(LCMV)は、ウイルスとマウスのどちらにも遺伝子改変を加えずに効率よく実験室マウスに感染する数少ないヒト病原ウイルスの一つです。そのため、LCMV感染マウスモデルはウイルス感染病態を理解するための貴重なツールとして特に免疫学の分野で広く利用され、MHC拘束性やT細胞疲弊といった重要な概念の確立に貢献してきました。また、LCMV感染実験にはBSL4施設を必要としないため、LCMVはラッサウイルスのモデルウイルスとしても利用されています。我々は多様なLCMV感染マウスモデルを用いて、特に免疫系細胞への感染機構や自然免疫応答が病態に与える影響を解析し、ウイルスが病気を引き起こすメカニズムの解明を目指しています。
– 新興ウイルス
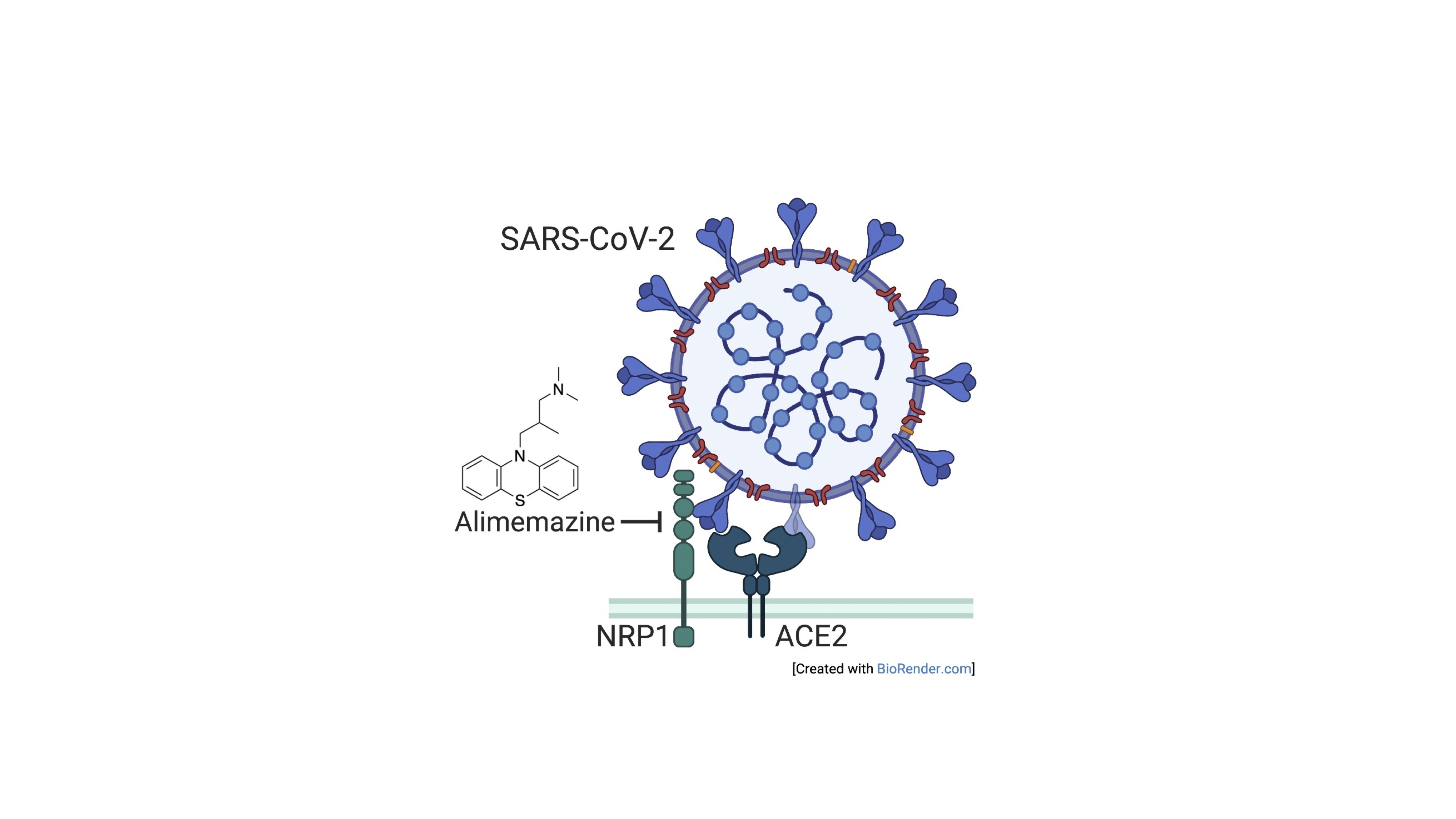
SARS-CoV-2の細胞侵入過程に注目した研究に取り組んでいます。当初アジア地域の低い死亡率との関連が指摘されていた受容体ACE2の遺伝子多型が、細胞侵入効率に与える影響は限定的であることを実験的に明らかにしました。また、SARS-CoV-2の細胞侵入過程を再現するシュードウイルスを用いた解析により、既存薬AlimemazineがSARS-CoV-2感染を強く阻害することを明らかにしました(図3)。
今後はラッサウイルスやSARS-CoV-2に加え、人類の脅威となっている他の新興ウイルスの研究にも取り組んでいきます。
メンバー
- 特任准教授: 岩﨑 正治
- 特任助教: 橋爪 芽衣
- 特任助教: 納田 遼太郎(兼)
ホームページ
最近の代表的な論文
- (1) Multifunctional noncoding regions in the mammarenavirus genome. Iwasaki M., Virology. (2025) 605:110464. Review.
(2) U-73122, a phospholipase C inhibitor, impairs lymphocytic choriomeningitis virus virion infectivity. Mizuma K., Hashizume M. et al., J Gen Virol. (2024) 105:002060.
(3) An mRNA-LNP-based Lassa virus vaccine induces protective immunity in mice. Hashizume M. et al., J Virol. (2024) 98:e0057824.
(4) Phenothiazines inhibit SARS-CoV-2 cell entry via a blockade of spike protein binding to neuropilin-1. Hashizume M. et al., Antiviral Res. (2023) 209:105481.
(5) The Pan-ErbB tyrosine kinase inhibitor afatinib inhibits multiple steps of the mammarenavirus life cycle. Mizuma K. et al., Virology (2022) 576:83-95.
(6) A small stem-loop-forming region within the 3′-UTR of a non-polyadenylated LCMV mRNA promotes translation. Hashizume M. et al., J Biol Chem. (2022) 298:101576.