難治感染症対策研究センター ウイルス免疫分野/小林研究室
ウイルス免疫分野では、研究室で独自に開発したウイルスの遺伝子操作系を活用し、ウイルスの病態発現機序解明や、新規ワクチンなどの治療法開発を目指し研究を展開しています。
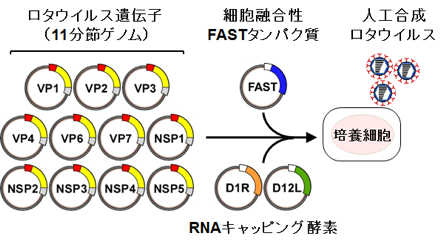
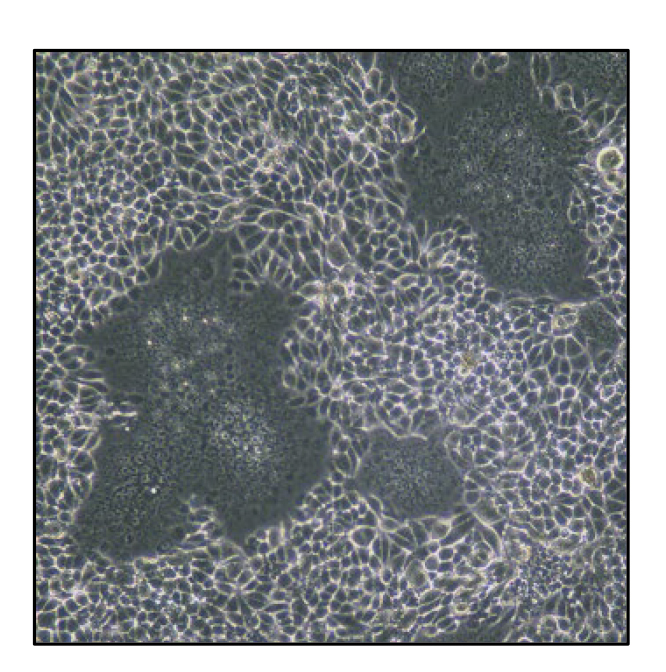
レオウイルス科のウイルスは、9~12分節に分かれた2本鎖RNAをゲノムに持つウイルスで、下痢症状を引き起こすことで知られるロタウイルスなどが属します。研究室では世界に先駆けてレオウイルスの遺伝子操作法を開発し、遺伝子組換えウイルスを人工的に作製する実験系を用いて研究を展開してきました。特に最近ではロタウイルスの遺伝操作系確立に世界で初めて成功し、遺伝子組換えロタウイルスを用いて、ウイルスの複製・病態発現機序の解明、新規ワクチンの開発を目指し研究を進めています。
また、長く非病原性のウイルスであると見なされていたレオウイルスのうち、コウモリ起源のネルソンベイレオウイルスはヒトへの感染により重篤な病原性を示す例が近年報告されています。研究室では、ネルソンベイレオウイルスの遺伝子操作系を用い、病原性獲得機序の解明にむけた解析を行っています。
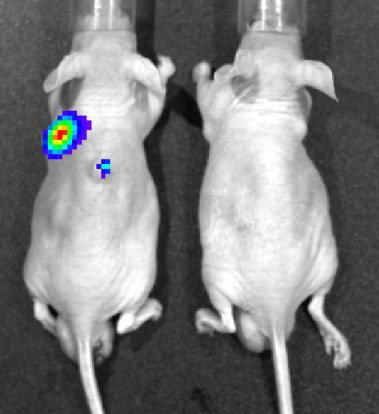
一方で、がん遺伝子Rasが活性化している腫瘍細胞で選択的に増殖し、細胞を溶解するという興味深い特徴を持つ哺乳類レオウイルスにも着目し、遺伝子組換えウイルスによるがん治療法や、がん細胞を可視化できるツールなど、ウイルスの医療応用を目指し研究を進めています。
研究室では世界に先駆けて分節型2本鎖RNAウイルス(レオウイルス科)のリバースジェネティクス系を開発し、遺伝子組換えウイルスを人工的に作製する実験系を用いて研究を展開してきました。特に最近ではロタウイルスのリバースジェネティクス系の確立に世界で初めて成功しました。現在、私達はレオウイルス科のリバースジェネティクス系を用いて、この科に属するウイルスの複製・病態発現機序の解明、新規ワクチンの開発を目指し研究を進めています。
1) ロタウイルス
ロタウイルスは乳幼児の急性胃腸炎の主な原因病原体で、医療の発展が遅れている開発途上国では、ロタウイルス感染によって死亡する乳幼児が多く存在しています。ロタウイルスは11分節の2本鎖RNAをゲノムとして持ちます。ロタウイルスではリバースジェネティクス系に開発が遅れていたことから、研究を進める上で大きな障壁となっていました。最近、私達は、ロタウイルスにおけるリバースジェネティクス系の開発に成功しました。現在、ロタウイルスの予防・治療法の確立を目的に、リバースジェネティクス系を用いて複製機構、病態発現機序の解明、ロタウイルスベクターの開発研究を行っています。
2) 哺乳類オルソレオウイルス
哺乳類オルソレオウイルス(レオウイルス)は、10分節の2本鎖RNAをゲノムとして持っています。レオウイルスは腫瘍細胞で選択的に増殖し、腫瘍細胞を溶解することから、頭頸部癌、大腸癌、乳癌、膵臓癌等の治療を目的とした、腫瘍溶解性ウイルスとしての研究が進んでいます。私達はレオウイルスのリバースジェネティクス系を導入・駆使することで、遺伝子改変レオウイルスを作出し、より安全で治療効果の高い腫瘍溶解性MRVの開発研究を行っています。また、レオウイルスを用いた経鼻・経口ワクチンベクターの開発にも取り組んでいます。
3) ネルソンベイオルソレオウイルス
コウモリはSARSコロナウイルス、ニパウイルス、エボラウイルス、狂犬病ウイルスなど多くの致死的感染を引き起こす人獣共通感染症のレゼルボアとして注目されています。 ネルソンベイオルソレオウイルスは、コウモリを自然宿主とし、ヒトに感染すると呼吸器疾患を引き起こすことから、コウモリからヒトに感染する人獣共通感染症と考えられています。このウイルスについては基礎研究が進んでおらず、予防法や治療法も確立されておりません。私達はネルソンベイオルソレオウイルスの増殖機構や病態発現機序の解明を目指しています。
メンバー
- 教授: 小林 剛
- 助教: 小瀧 将裕
- 助教: 川岸 崇裕
- 特任助教: 南 昌平
ホームページ
最近の代表的な論文
(1) Vero cell-adapted SARS-CoV-2 strain shows increased viral growth through furin-mediated efficient spike cleavage. Minami S. et al., Microbiology Spectrum (2023) e0285923
(2) Genetic engineering strategy for generating a stable dsRNA virus vector using a virus-like codon-modified transgene. Kanai Y. et al., Journal of Virology, (2023) 97(10):e0049223
(3) Characterization of Sialic Acid-Independent Simian Rotavirus Mutants in Viral Infection and Pathogenesis. Yamasaki M., et al., J. Virol. (2023) 97(1):e0139722
(4) N-Glycosylation of Rotavirus NSP4 Protein Affects Viral Replication and Pathogenesis. Nurdin JA., et al., J. Virol. (2023) 97(1):e0186122
(5) The nonstructural p17 protein of a fusogenic bat-borne reovirus regulates viral replication in virus species- and host-specific manners. Nouda R., et al., PLoS Pathog. (2022) 18(6):e1010553
(6) Development of an entirely plasmid-based reverse genetics system for 12-segmented double-stranded RNA viruses. Nouda R., et al., Proc Natl Acad Sci USA (2021) 118(42):e2105334118
(7) Generation of Genetically RGD σ1-Modified Oncolytic Reovirus That Enhances JAM-A-Independent Infection of Tumor Cells. Kawagishi T., et al. J Virol. (2020) Nov 9;94(23):e01703-20.
(8) Cell-cell fusion induced by reovirus FAST proteins enhances replication and pathogenicity of non-enveloped dsRNA viruses. Kanai Y., et al. PLoS Pathog. (2019) Apr 25;15(4):e1007675.
(9) Entirely plasmid-based reverse genetics system for rotaviruses. Kanai Y., et al., Proc Natl Acad Sci USA (2017) 114(9):2349-2354.