トランスフェリンとフェリチンの細胞周期制御における役割の相違性を解明 (幸谷研がRedox Biologyに発表)
本研究所の幸谷愛教授 (感染腫瘍制御分野)、栁谷稜特任助教 (当時) らの研究グループは感染症総合研究拠点 二宮彰紀特任助教、中央実験室 加藤寛子助教、および株式会社ペルセウスプロテオミクス (代表取締役社長 横川拓哉氏) 等との共同研究により、成熟NK細胞リンパ腫における細胞周期制御において、輸送鉄であるトランスフェリン結合鉄と貯蔵鉄であるフェリチン結合鉄は異なる役割を担っていることを明らかにしました。
ヒト体内の細胞、特に腫瘍 (がん) 細胞の生存や増殖には鉄イオンが重要であることは広く知られているところですが、特にがん細胞の細胞周期において鉄イオンがどのように寄与しているのか、包括的に解析された例はこれまでありませんでした。特に、細胞が主として利用する鉄イオンの様態には、トランスフェリンというタンパクに結合して主として細胞外から供給される「輸送鉄」と、フェリチンというタンパクに結合して主として細胞内に貯蔵される「貯蔵鉄」の2種類がありますが、それらの機能的な違いというのはこれまで「輸送」と「貯蔵」という面以外では詳しく調べられていませんでした。
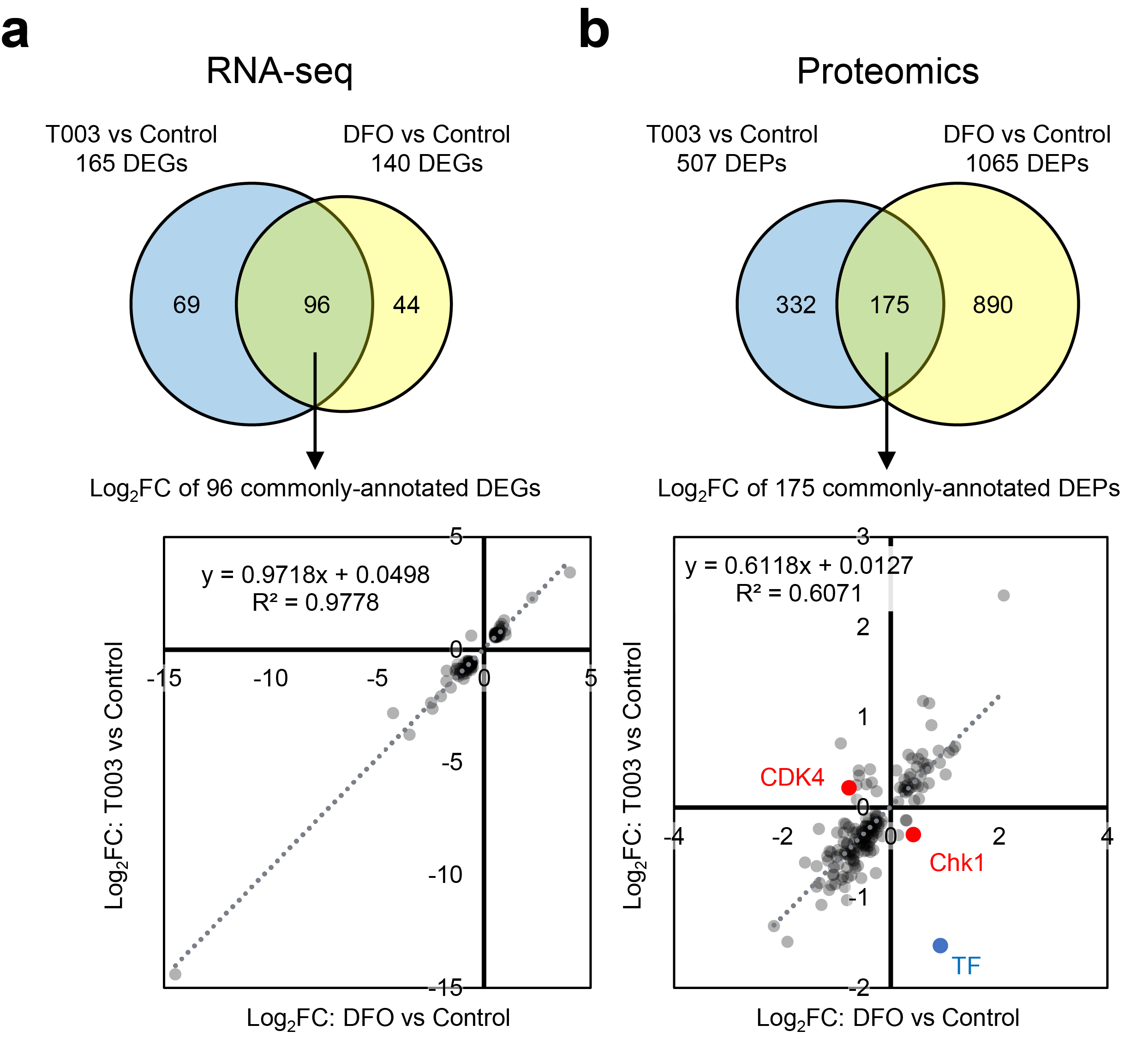
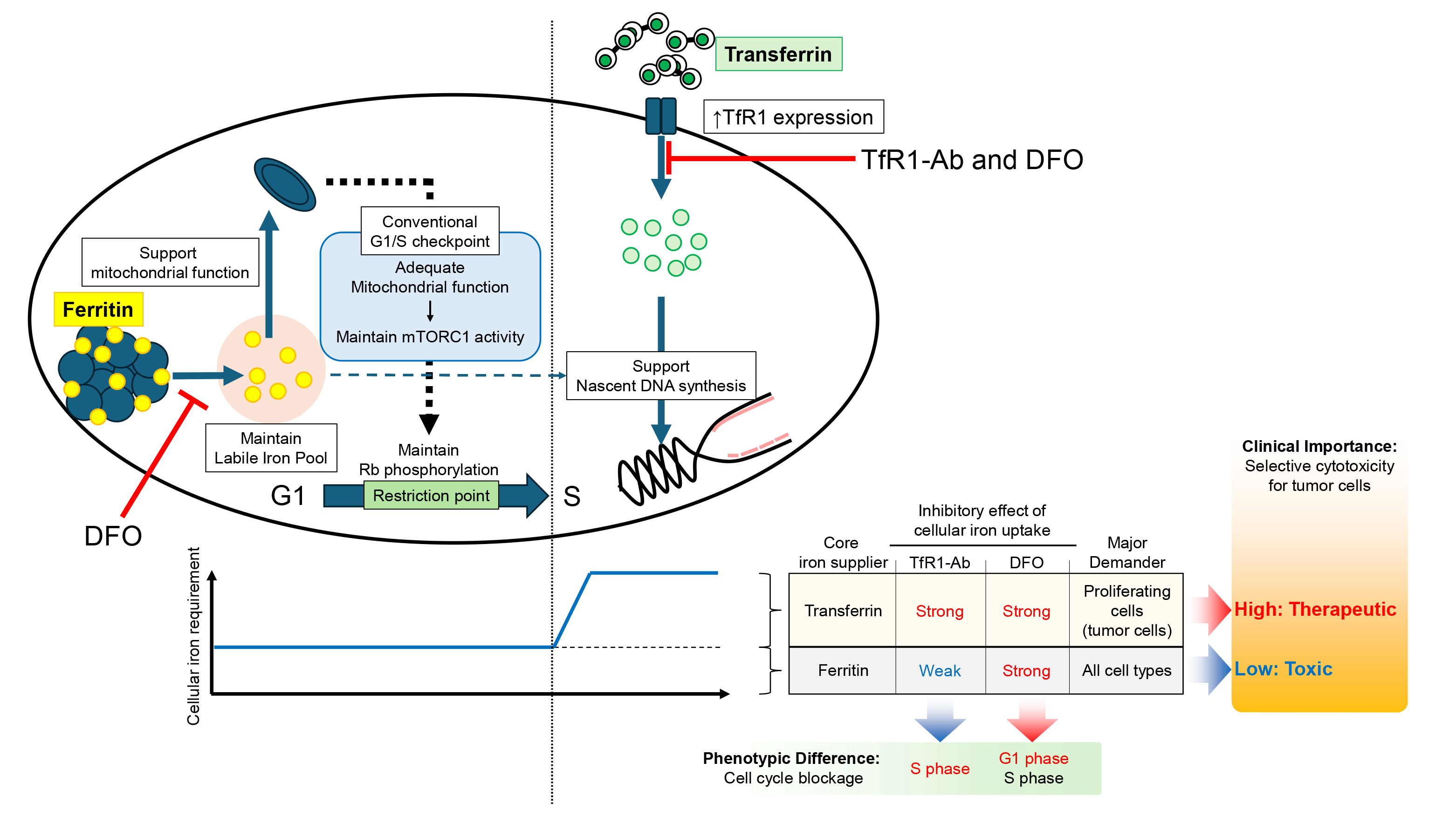
幸谷教授らの研究チームはこれまでに「アグレッシブNK細胞白血病」と呼ばれる成熟NK細胞リンパ腫の一種に対してトランスフェリン受容体阻害抗体であるPPMX-T003が顕著な抗腫瘍活性を示すことを明らかにし、その作用機序や薬剤耐性獲得機序の探索を行ってきました。その中で、PPMX-T003によってトランスフェリン由来の鉄 (=輸送鉄) のみを選択的に枯渇させた細胞は、従来の鉄キレート剤によって輸送鉄と貯蔵鉄の両者を枯渇させた細胞とは異なる場所で細胞周期が停止することを見出しました。この理由を探索するために、RNAシークエンス法によって両者の間で発現が変動している遺伝子を探索しましたが、明らかに発現挙動の異なる遺伝子は同定できませんでした。そこで中央実験施設協力のもと、高深度プロテオミクス法によって両者の間で発現変動しているタンパク質を網羅的に同定したところ、貯蔵鉄を枯渇された細胞ではミトコンドリア機能の障害が特異的に生じ、それによってmTORC1シグナルの低下、Rbの脱リン酸化を介して細胞周期がG1期で停止することが分かりました。一方で輸送鉄のみを枯渇させた条件ではそれらは正常に保たれる一方、細胞周期のS期においてDNAの複製が高度に障害されることで細胞周期停止に至ることが分かり、これらの背景から輸送鉄はDNA複製、貯蔵鉄はミトコンドリアの機能維持にそれぞれ重要な役割を持っている機能的な差異があることが示されました。
ミトコンドリア機能呼吸とエネルギー産生を司ることからがん細胞だけではなく正常細胞においても極めて重要であり、従来抗悪性腫瘍薬 (抗がん剤) として複数の治験が行われたデフェロキサミンなどの鉄キレート剤が重篤な副作用のために承認まで至らなかった理由として、鉄キレート剤が貯蔵鉄に対しても作用してしまうことが本研究結果から考察されました。対して幸谷教授らが現在開発を進めているPPMX-T003はがん細胞が輸送鉄を取り込むことを阻害する一方で貯蔵鉄に対する影響は軽微であるため、よりがん細胞に対する選択的な毒性を示すことが期待されます。
本研究成果は、2025年6月16日に蘭国科学誌「Redox Biology」(オンライン) に掲載されました。
タイトル:” Revised model for cell cycle regulation by iron: differential roles between transferrin and ferritin”
掲載誌:Redox Biology. 2025; 85: 103727
著者名:Ryo Yanagiya, Hiroko Kato, Akinori Ninomiya, Masaya Ueno, Akane Kanamori, Yuji Miyatake, Masahiro Oka, Keisuke Ishii, Tadashi Matsuura, So Nakagawa, Atsushi Hirao, Makoto Onizuka, and Ai Kotani
関連リンク
-
図1:RNAシークエンス (a) と高深度プロテオミクス (b) による、貯蔵鉄欠乏状態 (デフェロキサミン; DFOによる鉄キレート後の細胞) と輸送鉄欠乏状態 (PPMX-T003によるトランスフェリン受容体阻害処置後の細胞) の発現変動遺伝子のパターン解析。RNAシークエンスでは両者のプロファイルに殆ど差異が認められなかったが、高深度プロテオミクスでは主としてG1期の細胞周期に関与する分子 (CDK4) やDNAダメージに関連する分子 (Chk1) などで明らかな差異を検出することが出来た。
-
図2:本研究の全体像。フェリチン鉄 (貯蔵鉄:黄色) とトランスフェリン (輸送鉄:緑色) はそれぞれ細胞周期のG1期におけるミトコンドリア機能維持、S期におけるDNA複製という異なった時相で細胞周期を制御している。