Proc. Natl. Acad. Sci. USA. 111: 8877-82 2014/06/17
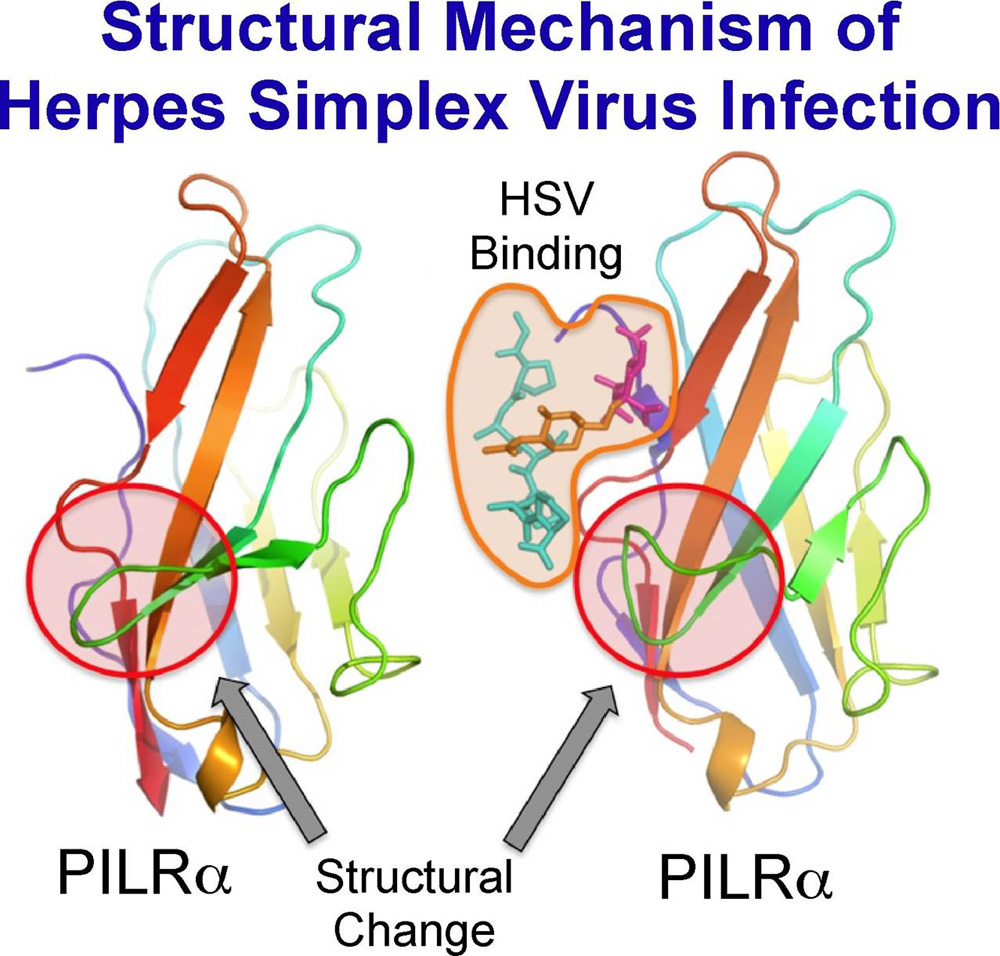
単純ヘルペスウイルス(herpes simplex virus, HSV)は脳炎や口唇ヘルペス、性器ヘルペス、皮膚疾患、眼疾患、小児ヘルペスなど、多様な疾患を引き起こす難治性の病原性ウイルスであり、日本だけでも年間数万人が治療を受けると言われています。単純ヘルペスウイルスは、エンベロープを持ったDNAウイルスの一つであり、エンベロープ表面の糖蛋白質が特定の宿主細胞表面分子と結合することにより膜融合が引き起こされ、ウイルスが細胞内に侵入します。我々は、PILRαは炎症等を抑制する免疫レセプターですが、単純ヘルペスウイルスのエンベロープ分子の一つであるGlycoprotein B (gB)と会合することで、ウイルスのエンベロープと細胞膜との膜融合を引き起こし、ウイルスの細胞内侵入に重要な機能を担っていることを明らかにしてきました。本研究では、PILRαとgBが結合した複合体の立体構造を初めて明らかにすることによって、単純ヘルペスウイルス感染時の膜融合の構造学的メカニズムを解明しました。その結果、PILRαはgBの糖鎖部分と蛋白質部分の両方を同時に認識するという特殊な認識機構を持っていることが明らかになりました。さらに、PILRαには、gBと結合することにより大きな構造変化が引き起こされ、このPILRαの構造変化が単純ヘルペスウイルス感染時に膜融合に関わっていると考えられました。今回明らかとなったPILRαの新しい認識機構と構造変化は、ウイルス侵入メカニズムの理解や侵入阻害剤の開発だけでなくPILRαによる広範な免疫機能の調節機構の理解とその調整薬やワクチンの効果を高める薬(免疫賦活化剤、アジュバント)の開発につながると考えられます。詳しい説明は
http://www.ifrec.osaka-u.ac.jp/jpn/research/荒瀬%20PNAS%20解説_20140603.pdf