1.T細胞エピトープの探索
MHCは抗原蛋白由来のクラスⅠ(CD8T細胞)だと約9アミノ酸、クラスⅡ(CD4T細胞)だと約15アミノ酸のペプチド断片がMHCと複合体をつくることでT細胞がTCRを介して認識します。(図)
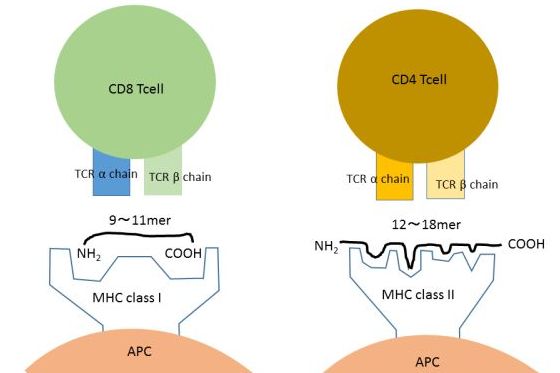
これらのペプチド(T細胞エピトープ)を見つけるには下記の二つの方法が知られています。
1) Overlapping peptide library screening法(ref.1)
(長所) ライブラリー中に存在すれば確実にT細胞エピトープを同定出来る。
(短所) 抗原蛋白質がすでに分かっている必要がある。ゲノムサイズが大きくなると抗原蛋白質そのものを見つけることが難しくなる。
2) In silico screening (computer prediction)法(ref.2)
(長所)MHCに強く結合するペプチドを効率よく予測できる。
(短所)MHCに結合すると予測されたヘプチドのほとんどに対してT細胞は反応しないため、膨大な数のペプチドを合成しT細胞応答を確認しなければならない。
しかしながら、これらの方法では、完全に未知でかつ候補抗原が膨大である、自己免疫疾患、がん、感染症などにおける主要なT細胞エピトープを見つけるのは非常に難しいのが現実です。
私たちは、自己免疫疾患、がん、感染症において、その病因や防御に関与するT細胞エピトープを網羅的に同定する新しいシステムの構築・研究開発を進めています。
(ref.1)Suzuki M, Aoshi T, Nagata T, Koide Y. Identification of murine H2-Dd-
and H2-Ab-restricted T-cell epitopes on a novel protective antigen, MPT51,
of Mycobacterium tuberculosis. Infect Immun. 2004 Jul; 72(7):3829-37.
(ref.2)Aoshi T, Suzuki M, Uchijima M, Nagata T, Koide Y. Expression mapping
using a retroviral vector for CD8+ T cell epitopes:definition of a Mycobacterium
tuberculosis peptide presented by H2-Dd. J Immunol Methods. 2005 Mar; 298(1-2):21-34
2.抗原提示における免疫細胞間相互作用の理解
特定の免疫応答(CD4T細胞、CD8T細胞、抗体産生、等)にはそれぞれに特定の抗原提示細胞が重要な役割を果たしていることが分かってきました。高い安全性と確実な有効性を有する次世代ワクチンの開発においては、目的とした免疫応答の誘導に関与する抗原提示細胞により選択的に抗原を標的することが重要であると考えています。
例えば、リステリア感染時に誘導されるCD8T細胞応答にはCD8a陽性樹状細胞が重要な役割を果たし(ref.3,4,5)、インフルエンザ全粒子ワクチンでは主にpDCsが活性化され、そのpDCがインフルエンザに対するTh1型CD4T細胞応答に重要であることが明らかにしてきました(ref.6)。
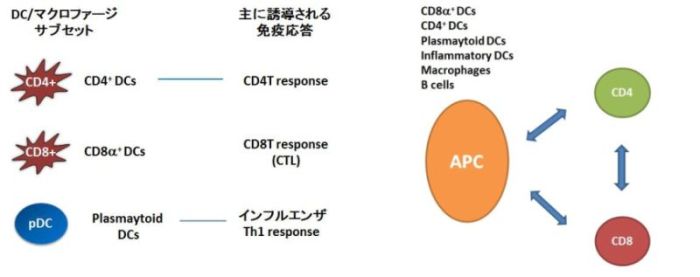
私たちは適切な抗原提示細胞への標的法の開発や抗原提示の場における抗原提示細胞-T細胞間の相互作用の可視化を通して、各種抗原提示細胞によって誘導される免疫応答およびCD4/CD8T細胞間相互作用メカニズムを解明し、それらの知見に基づいたより高い安全性と確実な有効性を有する次世代型ワクチンの研究開発を行います。
(ref.3)Aoshi T, Zinselmeyer BH, Konjufca V, Lynch JN, Zhang X, Koide Y,
Miller MJ. Bacterial entry to the splenic white pulp initiates antigen
presentation to CD8+ T cells. Immunity. 2008 Sep 19; 29(3):476-86. doi:10.1016/j.immuni.2008.06.013..
(ref.4)Aoshi T, Carrero JA, Konjufca V, Koide Y, Unanue ER, Miller MJ. The cellular
niche of Listeria monocytogenes infection changes rapidly in the spleen.
Eur J Immunol. 2009 Feb; 39(2):417-25. doi: 10.1002/eji.200838718.
(ref.5)Edelson BT, Bradstreet TR, Hildner K, Carrero JA, Frederick KE, KC W, Belizaire
R, Aoshi T, Schreiber RD, Miller MJ, Murphy TL, Unanue ER, Murphy KM. CD8α(+)
dendritic cells are an obligate cellular entry point for productive infection
by Listeria monocytogenes. Immunity. 2011 Aug 26; 35(2):236-48. doi: 10.1016/j.immuni.2011.06.012.
(ref.6)Koyama S, Aoshi T, Tanimoto T, Kumagai Y, Kobiyama K, Tougan T, Sakurai
K, Coban C, Horii T, Akira S, Ishii KJ. Plasmacytoid dendritic cells delineate
immunogenicity of influenza vaccine subtypes. Sci Transl Med. 2010 Mar
31;2(25):25ra24. doi: 10.1126/scitranslmed.3000759.
3.A/D型CpG核酸アジュバントの開発・改良
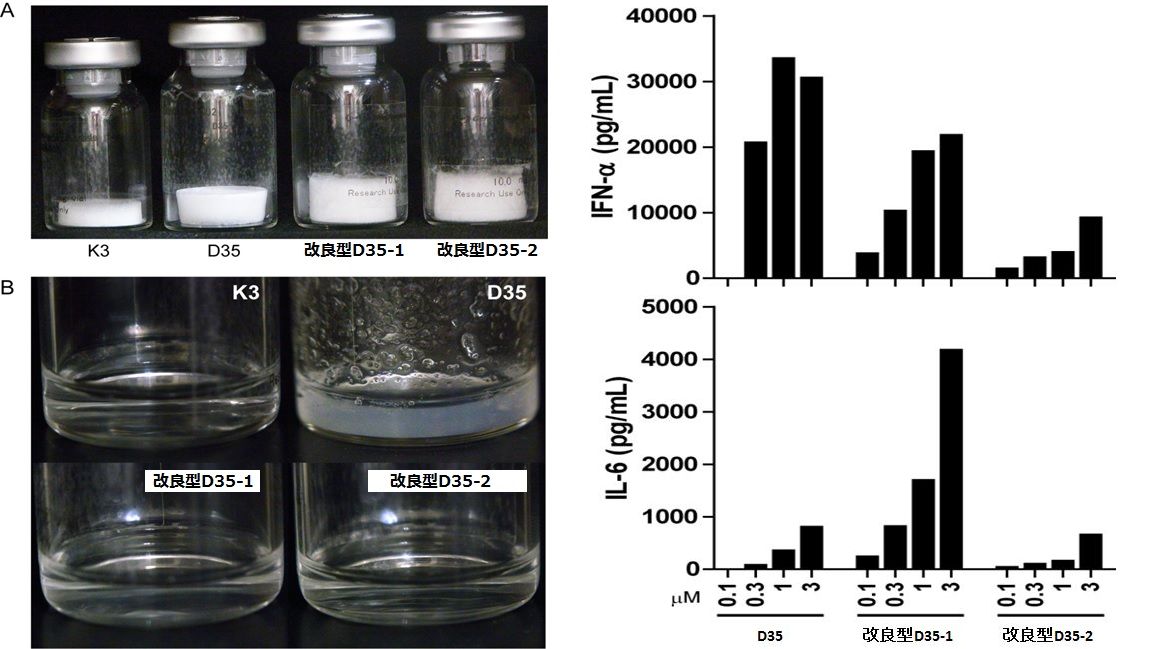
K3型(B/K型)とD35型(A/D型)は共に優れた免疫賦活化CpG核酸アジュバントで、その活性はTLR9に依存します。K3型は主にB細胞に作用し、IL-6の発現を強く誘導することが知られています。一方で、D35型は形質細胞様樹状細胞 (pDC)に作用し、IFN-αの発現を強く誘導する特徴があります。
B/K型CpGは現在B型肝炎に対するワクチンアジュバントとして海外で臨床開発が進行しています。一方、A/D型CpG核酸アジュバントは未だに確実な治療法がなく顧みられない熱帯病(Neglected Tropical Diseases; NTDs)の1つであるリーシュマニア感染症に対して有効であることがサルで確認され、有効な治療薬の1つとして期待されていますが、生理食塩水に不溶の為、B/K型と比較して開発が遅れていました。
私たちは最近、生理食塩水に不溶であるというA/D型CpG核酸アジュバントの性質を克服し、高いIFN-α誘導活性を有しかつ生理食塩水に溶解可能な改良型D35の開発に成功しました(ref.7)。ただ改良型D35の作用メカニズムについてはまだ詳しいことはわかっていません。またK3型とD35型の生理活性はともにTLR9に依存するにも関わらず、それぞれ宿主に対する効果がなぜ異なるのかもよくわかっていません。
A/D型CpGアジュバントの臨床応用を目指した研究開発とその作用メカニズムの解析を行います。
PBS/生食に溶解可能な改良型D35
Aoshi et al. Journal of Immunology Research. Volume 2015 (2015),
Article ID 316364, http://dx.doi.org/10.1155/2015/316364.
特許出願中(特願:2015-118731)
(ref.7)Aoshi T, Haseda Y, Kobiyama K, Narita H, Sato H, Nankai H, Mochizuki S, Sakurai K, Katakai Y, Yasutomi Y, Kuroda E, Coban C, and K. Ishii. Development of non-aggregating poly-A tailed immunostimulatory A/D-type CpG oligodeoxynucleotides applicable for clinical use. Journal of Immunology Research. Volume 2015 (2015), Article ID 316364, http://dx.doi.org/10.1155/2015/316364.