自己免疫を起こさないがん免疫活性化法を開発(山本研がScienceに発表)
本研究所感染病態分野 山本雅裕教授(免疫学フロンティア研究センター、感染症総合教育研究拠点兼任)らの研究グループは、腫瘍内のアルギナーゼ1 (Arg1)を産生するマクロファージ (Arg1+ TAM)が産生するケモカインPF4がTh1-Tregを誘導し、がん免疫を抑制することを明らかにしました。
研究成果のポイント
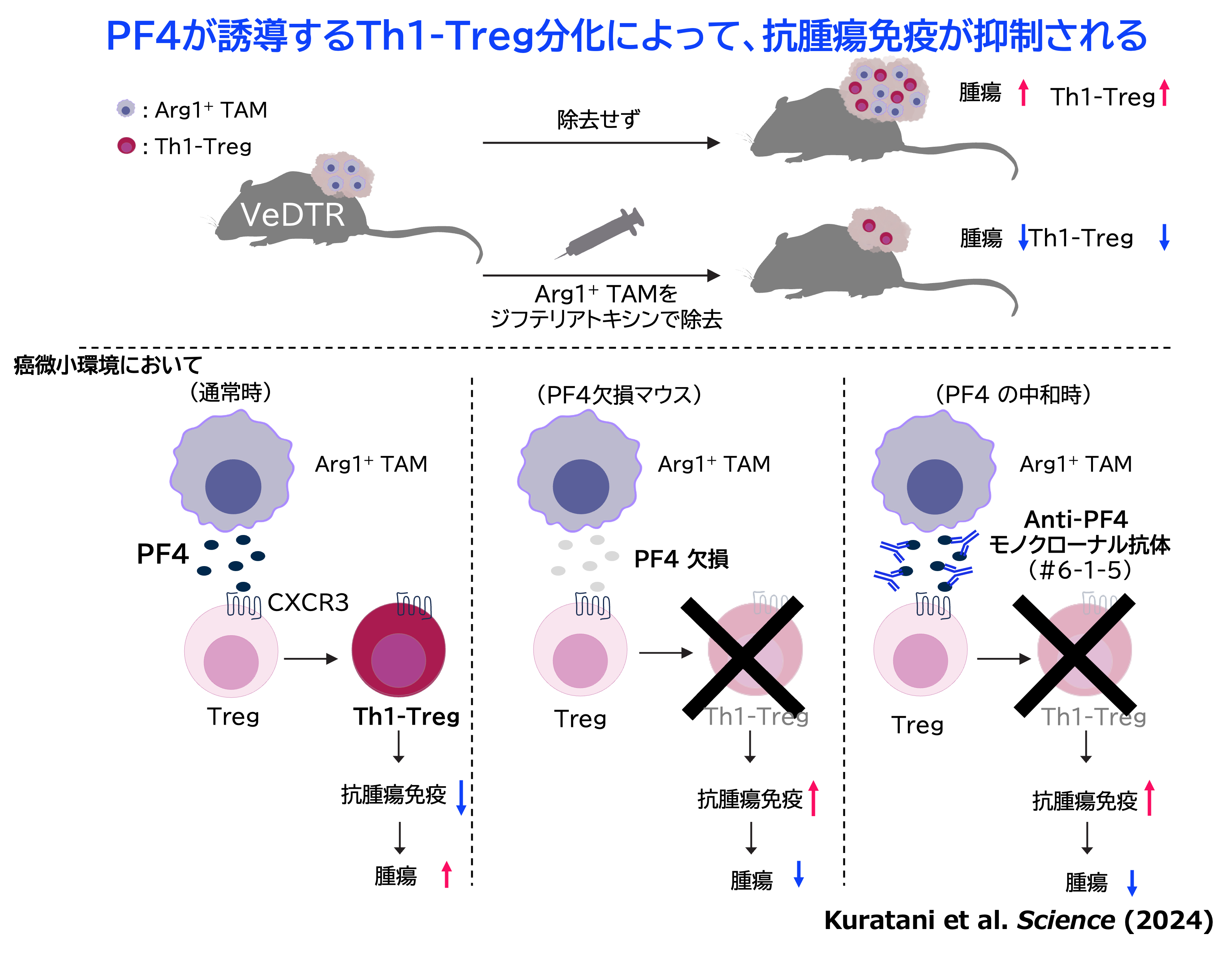
- Arg1※1産生腫瘍随伴マクロファージ※2 (Arg1+ TAM)が産生するケモカインPF4ががん免疫を抑制するTh1-Treg※3の分化を誘導し、腫瘍の増殖につながっていることが判明
- PF4を中和することで、Th1-Tregの分化が阻害され、がん免疫を活性化し、かつ自己免疫を起こさずに、腫瘍の増殖を抑制できることを発見
- PF4を標的とする安全性の高い抗腫瘍免疫治療につながる可能性
これまで腫瘍内において強力にがん免疫を抑制するTregのサブセットの一つであるTh1-Tregが腫瘍内に高度に蓄積することが分かっていましたが、なぜそのようになるのか、その分子メカニズムは全く不明でした。今回、山本教授らのグループはArg1+ TAMを特異的に標識・除去可能な遺伝子改変マウスをVeDTRマウス※4システムにより作製し、腫瘍随伴マクロファージの役割を検討しました。担癌ウスでArg1+ TAMを除去したところ、腫瘍内Th1-Tregの割合の減少とがん免疫の強い活性化が確認されました。さらに、Arg1+ TAMが産生する液性因子PF4(別名CXCL4)がTregのTh1-Tregへの分化に関与することを明らかにしました。PF4欠損マウスや抗PF4中和抗体の投与によるPF4の機能の阻害によって、がん組織内Th1-Tregの割合の減少に伴うがん免疫の強い活性化が確認され、その結果、腫瘍増殖の抑制が確認されました(上図)。さらにPF4中和抗体の投与は、全Treg除去で起きる自己免疫になりませんでした。以上のことから、PF4が安全性の高い抗腫瘍免疫治療の新規標的となる可能性が大いに期待されます。
本研究成果は、2024年11月22日(金)午前4時(日本時間)に米国科学誌「Science」(オンライン)に掲載されました。
タイトル:“Platelet factor 4-induced Th1-Treg polarization suppresses anti-tumor immunity”
著者名:Ayumi Kuratani, Masaaki Okamoto, Kazuki Kishida, Daisuke Okuzaki, Miwa Sasai, Shimon Sakaguchi, Hisashi Arase, Masahiro Yamamoto
DOI: 10.1126/science.adn8608
用語説明
※1 Arg1
アルギナーゼ1。L-アルギニンをL-オルニチンと尿素に加水分解する酵素。増殖しているリンパ球やがん細胞において高い活性を示す。
※2 腫瘍随伴マクロファージ
腫瘍組織内に浸潤・集積しているマクロファージ(Tumor-associated macrophage, TAM)。大部分は腫瘍に対する免疫応答を抑制し、腫瘍の増殖の促進に関与することが報告されている。
※3 Th1-Treg
制御性T細胞(Treg細胞)はヘルパーT細胞の一種であり、免疫応答を抑える機能を持ち、免疫恒常性の維持と自己免疫の抑制に重要な役割を果たす細胞である。転写因子Foxp3を特異的に発現する。
腫瘍内に浸潤するTregはさらにT-betも発現することがあり、Th1 型 Treg (Th1-Treg)と呼ばれており、Th1依存的な免疫応答(腫瘍においては抗腫瘍免疫)を特異的に抑制することを、昨年、山本研究室が報告した。(参考:2023.7.14プレスリリース「Th1型制御性T細胞の除去は安全にがん免疫を誘導する」)。
※4 VeDTRマウス
昨年、山本研究室が上記論文で開発を報告した新型マウス。VeDTRマウスの中では、Cre-loxPシステムとFlp-FRTシステムという2つの部位特異的リコンビナーゼを組合せ、2種類の遺伝子の発現で特徴づけられた任意の細胞集団において蛍光タンパク質およびヒト型のジフテリアトキシン受容体(DTR)を発現できる。ジフテリアトキシンはヒトやサルには毒性が強いが、マウスでは毒性が低いという特徴を持つ。したがって、VeDTRマウス内でジフテリアトキシンがヒト型DTRに作用すると、特定の細胞だけが除去される。