N結合型糖鎖によるGPIアンカー構造変化の調節機構が明らかに(木下研がJ. Cell Biol.誌に発表)
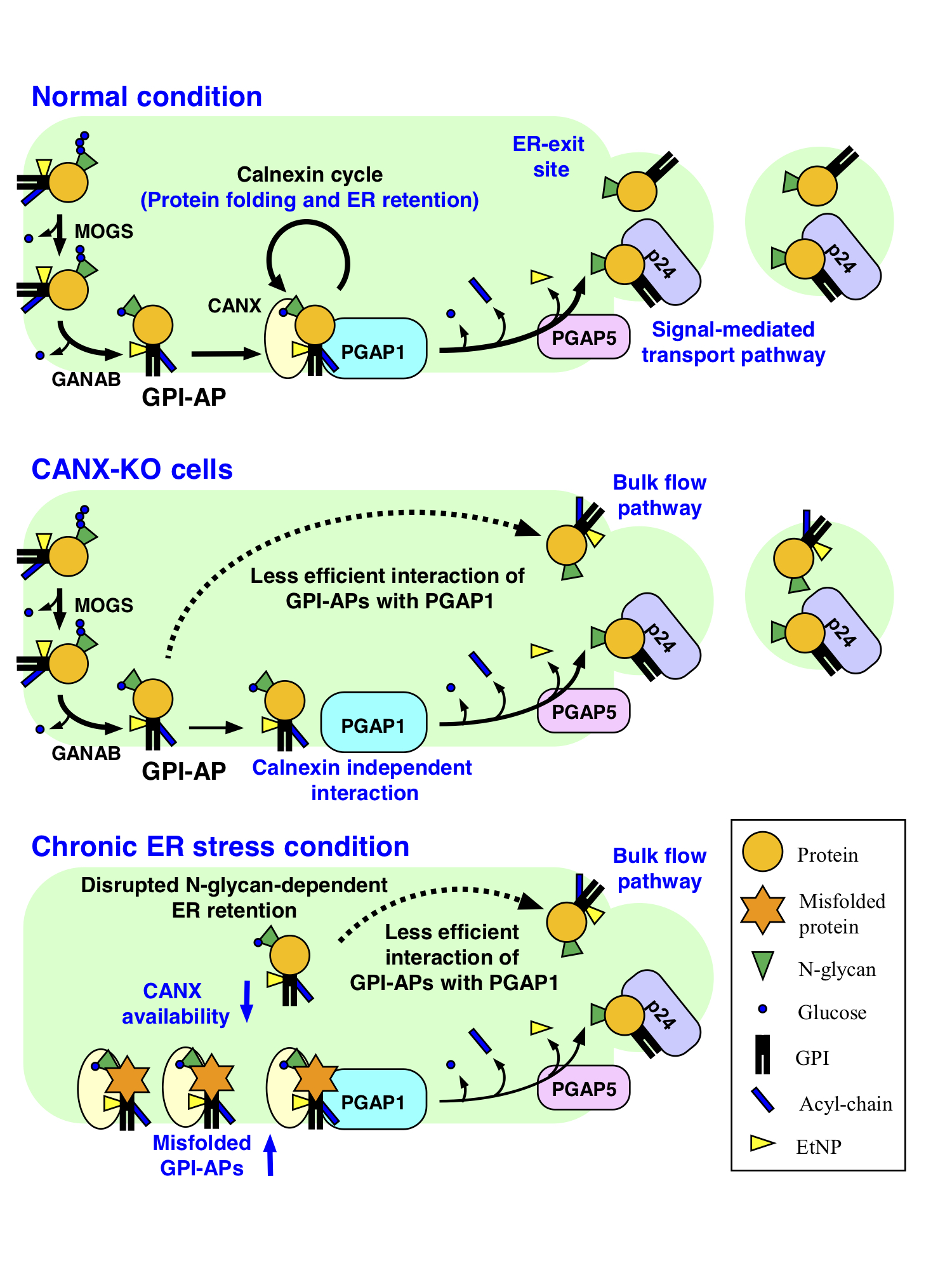
タンパク質の多くは合成された後に様々な修飾(翻訳後修飾)を受けることが知られています。これらの修飾によって、タンパク質の構造や機能、局在が調節されています。細胞表面にはグリコシルホスファチジルイノシトール(GPI)と呼ばれる糖脂質によって細胞膜に結合したタンパク質(GPIアンカー型タンパク質)が多く存在しています。このGPIによるタンパク質の修飾は真核生物種間で広く保存された翻訳後修飾の一つです。これまで、GPIの構造がタンパク質に付加された後に変化すること、それがGPIアンカー型タンパク質の輸送や局在に大事であるという事を明らかにしてきました。しかしながら、GPIの構造変化がどのように調節されているかは不明でした。
今回、私達はGPIの構造変化の一つ(GPIイノシトール脱アシル化)に注目し、この調節に関わる因子を探索しました。その結果、タンパク質上の別の翻訳後修飾であるN結合型糖鎖が、GPIの構造変化を調節していることを明らかにしました。タンパク質上のN結合型糖鎖は、GPIと同様、小胞体で付加され、タンパク質の折り畳みに重要な役割を担っています。カルネキシンと呼ばれる分子シャペロンはN結合型糖鎖およびGPIアンカー依存的にGPIアンカー型タンパク質と結合しました。この作用により、タンパク質は一時的に小胞体に留められ、GPIイノシトール脱アシル化酵素に効率よく相互作用できることを明らかにしました。さらに、慢性的な小胞体ストレスによって、この機構が破綻するとGPIアンカー型タンパク質がプロセシングされないまま、細胞表面に出てきてしまうことが分かりました。小胞体において、GPIの付加とN結合型糖鎖の二つの翻訳後修飾が連携して、タンパク質の折り畳みや輸送を調節している機構の一端を明らかにしました。
本研究は籔本難病解明寄附研究部門 木下タロウ研究室、藤田盛久(中国 江南大学 教授および微生物病研究所 招へい教授)グループと中村昇太(微生物病研究所 感染症メタゲノム研究分野 特任准教授)グループとの共同で行われたものです。
本研究成果は2017年12月18日にThe Journal of Cell Biology誌に掲載されました。