抗病原体分子をバランスよく配置して免疫反応を効率化!(山本研がNat. Immunology誌に発表)
寄生虫「トキソプラズマ」は原虫(単細胞の寄生虫)の一つであり、世界人口の約3割に感染しているとされています。免疫機能が正常な健常人ではトキソプラズマに感染してもほとんど症状はありませんが、エイズや抗癌剤投与下のガン患者あるいは免疫抑制剤を投与されている免疫不全者において致死性の脳症や肺炎を引き起こします。また妊婦が初感染した際に胎盤を通じて胎児に感染し、流産や死産あるいは感染したまま新生児が生まれ水頭症や網脈絡膜炎などを主症状とする先天性トキソプラズマ症を発病している例が近年マスコミなどでも取り上げられています。また「サルモネラ菌」は食中毒を起こす代表的な細菌であり、平成28年には我が国で31件のサルモネラ菌が関係する食中毒が起き、704人の患者が出ています。以上のように、日本においても「トキソプラズマ」や「サルモネラ菌」は依然として病気を引き起こす病原体です。
トキソプラズマやサルモネラ菌は我々宿主(しゅくしゅ)の体内に入りマクロファージなどの免疫細胞の中に「病原体含有小胞」で総称される膜状の特殊な構造体を作って感染して増殖します(左図下)。トキソプラズマの細胞内感染に対して宿主の体では免疫反応が起きます。最も重要な因子はインターフェロン ガンマと呼ばれるサイトカインであり、インターフェロンが誘導する様々なタンパク質群が病原体含有小胞に蓄積した上で、病原体含有小胞を破壊してトキソプラズマやサルモネラ菌を細胞内で殺傷しています。しかし、インターフェロン誘導性タンパク質がどのようにして効率よくトキソプラズマやサルモネラ菌の「病原体含有小胞」に蓄積しているのかについては良くわかっていませんでした。
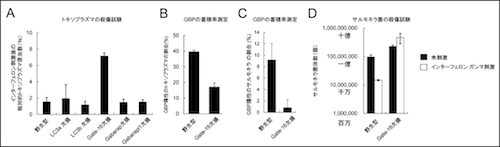
私達の研究グループは、LC3a, LC3b, Gabarap, Gabarapl1, Gate-16という5つのメンバーからなるATG8ファミリー分子群に着目し、それぞれの遺伝子欠損細胞をゲノム編集法で作製しました。ゲノム編集法で遺伝子欠損細胞を作製したことにより、従来の胚性幹(ES)細胞を用いたノックアウト技術よりも、研究期間を大幅に短縮することに成功しました。その結果、この5つの中でGate-16を欠損した細胞では、インターフェロン ガンマ刺激によるトキソプラズマの原虫数の低下しにくいことが分かりました(図1A)。次にインターフェロン誘導性タンパク質のトキソプラズマの病原体含有小胞への蓄積について検討したところ、インターフェロン誘導性タンパク質であるGBP(トキソプラズマ破壊のための最も重要な宿主免疫分子;2012年7月発表)の蓄積がGate-16欠損細胞では野生型細胞に比べて有意に低下していました(図1B)。またサルモネラ菌の病原体含有小胞へのGBPの蓄積もGate-16欠損細胞では低下し(図1C)、さらにインターフェロン ガンマ刺激による菌数の低下がGate-16欠損細胞ではほとんどみられませんでした(図1D)。
(クリックで拡大)
図1 Gate-16欠損細胞では、インターフェロン ガンマ刺激によるトキソプラズマとサルモネラ菌の殺傷応答が低下している
(A)各線維芽細胞にトキソプラズマを感染させ、インターフェロンガンマ刺激前と後の原虫数を相対値で示した。Gate-16欠損細胞だけが、他のATG8欠損細胞よりも原虫数が多いことがわかる。
(B、C)野生型及びGate-16欠損線維芽細胞にトキソプラズマ(B)及びサルモネラ菌(C)を感染させ、GBPの蓄積率を検討した。どちらもGate-16欠損細胞でGBPの蓄積率が低下していた。
(D)未刺激(黒)またはインターフェロンガンマ刺激(白)した野生型及びGate-16欠損線維芽細胞にサルモネラ菌を感染させ、菌数を計測した。野生型ではインターフェロン刺激後に菌数が10分の1に減っているの対して、Gate-16欠損細胞では減っていなかった。
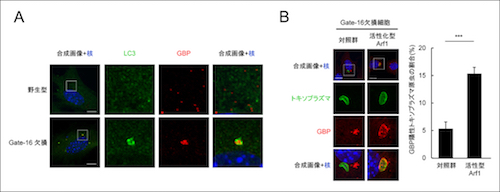
GBPは通常、インターフェロン刺激した未感染細胞では粒状で細胞質に均一に「遍在」しています。一方、Gate-16欠損細胞では、細胞質内の数箇所に凝集し「偏在」していました(図2A)。逆にGate-16欠損細胞であっても、GBP凝集体を共生的に壊し、均一に「遍在」させるとGBPがトキソプラズマの病原体含有小胞に蓄積できました(図2B)。これらのことから、GBPがGate-16依存的に細胞質内に均一に「遍在」することが、抗病原体応答に重要であることがわかりました。
(クリックで拡大)
図2 Gate-16欠損細胞ではGBPが凝集体を形成し不均一に偏在するが、それを解消するとGBP依存的な免疫応答が回復する
(A) 野生型及びGate-16欠損線維芽細胞をインターフェロン ガンマで刺激し、GBP(赤)及びLC3(緑)で染色した。GBPは野生型では粒状にバランスよく細胞質内に配置されているのに対して、Gate-16欠損細胞では数箇所に凝集していた。
(B) Gate-16欠損細胞に、活性化型Arf1を過剰発現させるとGBP凝集体が解消し、GBPがトキソプラズマの病原体含有小胞に蓄積した。
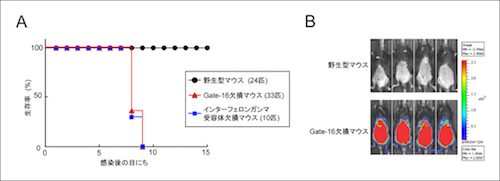
最後に、マウス個体レベルでGate-16の役割を検討するために野生型及びGate-16欠損マウス、インターフェロン ガンマ受容体欠損マウスにトキソプラズマを感染させたところ、Gate-16欠損マウスはインターフェロン ガンマ受容体欠損マウスと同程度に劇的にトキソプラズマに対して高い感受性を示し(図3A)、さらに感染したGate-16欠損マウスでは原虫数が劇的に増加していました(図3B)。このことから、個体レベルでもGate-16が抗病原体応答に重要であることがわかりました。
(クリックで拡大)
図3 Gate-16欠損マウスはトキソプラズマ感染に劇的に弱い
(A) 野生型、Gate-16欠損及びインターフェロンガンマ受容体欠損マウスにトキソプラズマを腹腔感染し、マウスの生存率を経時的に測定した。野生型マウスは1匹も死ななかったのに対して、Gate-16欠損マウスとインターフェロンガンマ受容体欠損マウスは全数死亡し、そのタイミングも同じであった。
(B) ルシフェラーゼ発光するトキソプラズマを、野生型及びGate-16欠損マウスに感染させ、7日後に生体イメージング装置で測定した。Gate-16欠損マウスの腹腔内には野生型マウスに比べて著しく多い原虫が存在していた。
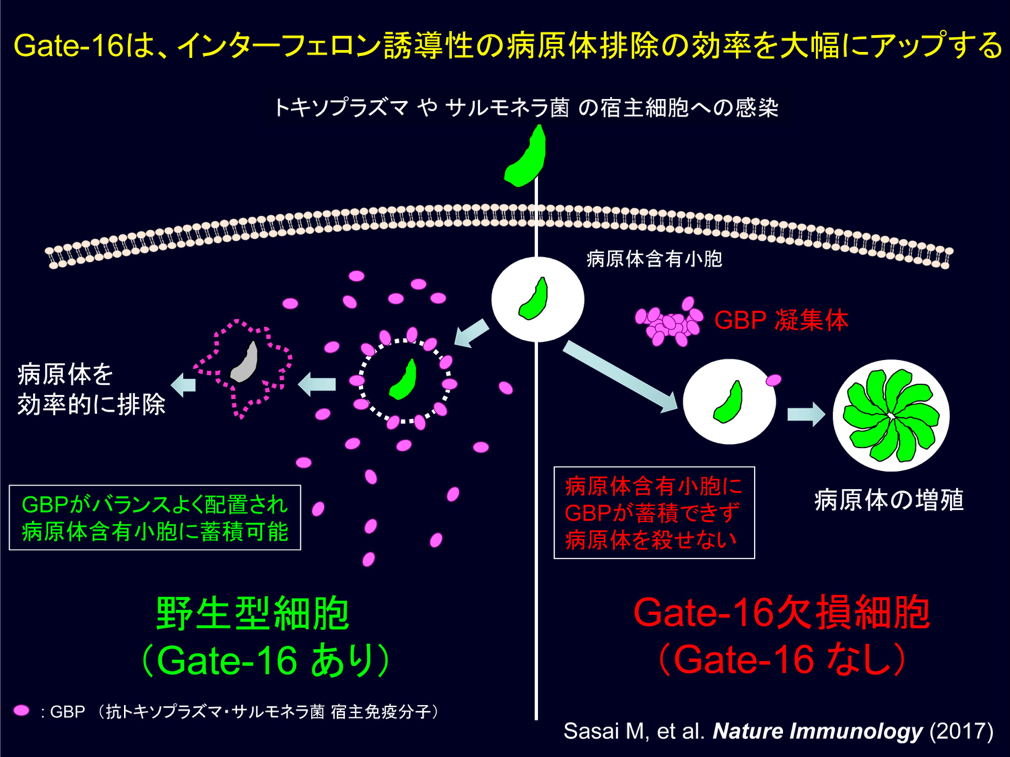
以上の結果から、Gate-16は抗トキソプラズマ・サルモネラ菌宿主免疫分子GBPを細胞質内であらかじめバラバラと(バランスよく)配置することによって、それらの病原体がどこから侵入してきてもGBPと遭遇するように用意し、抗病原体応答の効率的に引き起こしていると考えられます(左図上)。
本研究で私達の研究グループは、Gate-16がインターフェロン ガンマ依存的な抗病原体免疫反応を著しく効率アップすることを発見しました。今後Gate-16の活性を人為的に制御することで、トキソプラズマ症やサルモネラ菌の食中毒の発病を食い止める新規の治療・予防戦略を提供できることが期待されます。
本研究成果はNature Immunology誌に2017年6月13日にオンライン掲載されました。
Essential role for GABARAP autophagy proteins in interferon-inducible GTPase-mediated host defense
Nature Immunology 2016, doi: 10.1038/ni.3767
国立研究開発法人日本医療研究開発機構(AMED)ウェブサイト内研究成果ページ