J. Cell Biol. 194: 61-75 (2011)2011/07/04
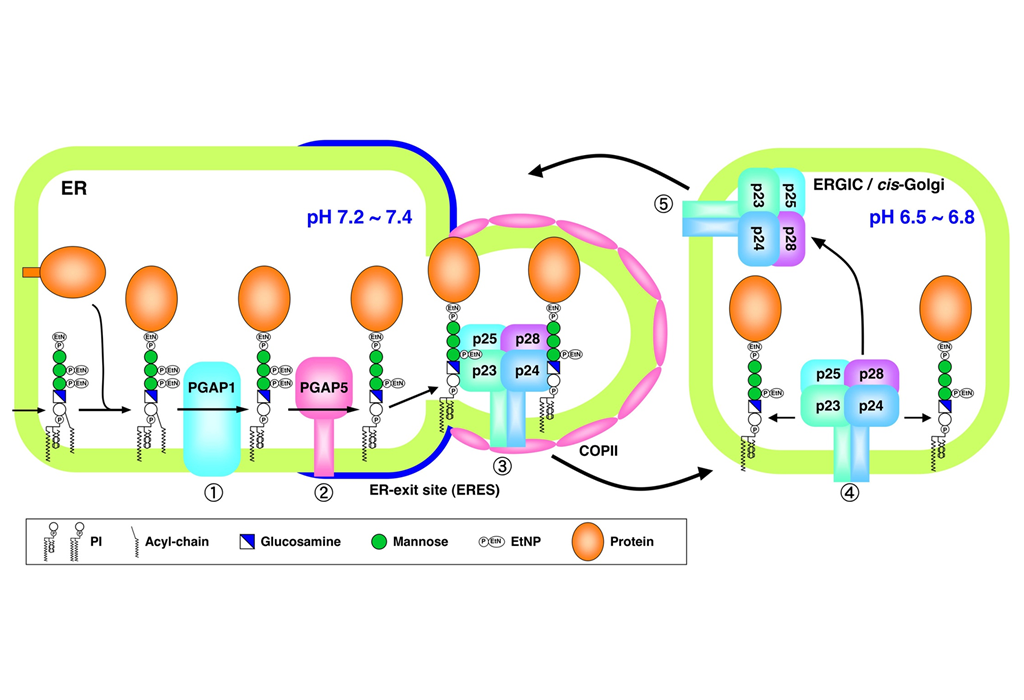
細胞表面膜上には糖脂質グリコシルホスファチジルイノシトール(GPI)によって膜に結合する一群のタンパク質(GPIアンカー型タンパク質)が存 在する。今回、我々は小胞体におけるGPIアンカーの2つの構造変化がタンパク質の小胞体出口部位へのソーティングに必要であることを見出した。すなわ ち、PGAP1によるイノシトール残基の脱アシル化、およびPGAP5によるマンノース残基の脱リン酸化の不全細胞では、GPIアンカー型タンパク質が小 胞体出口部位へ濃縮されないために、輸送遅延が起こっていた。さらに、構造変化したGPIアンカー型タンパク質はp24ファミリータンパク質によって効率 的に認識され、輸送小胞に濃縮されることを明らかにした。GPIアンカー型タンパク質とp24ファミリータンパク質の結合はpH依存的であり、小胞体で両 者が結合し、輸送後に小胞体・ゴルジ体中間区画(ERGIC)またはゴルジ体で解離することが示唆された。我々の結果はp24タンパク質が正しくリモデリ ングを受けたGPIアンカーを認識し、GPIアンカー型タンパク質の小胞体-ゴルジ体間の輸送を行う積荷受容体として機能していることを示すものである。