活性酸素は呼吸に伴う副産物として古くから研究されており、生体物質を酸化傷害する「毒物」という認識が定着している。そして今日、社会の高齢化に伴って老化現象やそれに対抗するアンチエイジング(抗老化)に注目が集まるとともに、活性酸素の重要性が一般的にも広く認識されるようになった。がんや神経変性疾患などの病気を引き起こす要因としての理解も進んでいる。しかしその一方で、活性酸素が細胞内外での情報伝達に積極的な役割を果たしていることが明らかとなりつつある。つまり、私たちは過剰な活性酸素から逃れると同時に、それをシグナルとしても利用しており、その正負両面の微妙なバランスの上に生命が成り立っている。
物質の化学反応性は電子状態によって規定されているが、酸素分子「O2」は基底状態で不対電子を二つ有するフリーラジカルであり、反応性が高い。ここに電子が一つ付加されるとスーパーオキシド「O2-」を生じ、酸素分子よりも高い反応性を示す。生体内において、スーパーオキシドはスーパーオキシドディスムターゼ(SOD: superoxide dismutase)と呼ばれる酵素のはたらきで、過酸化水素「H2O2」に変換される。過酸化水素はカタラーゼやペルオキシレドキシンなどのはたらきで水に変換され、安定的な物質となる。一方、遊離Fe2+やCu+の存在下では過酸化水素からヒドロキシラジカル「・OH」という強力な反応性をもつ物質ができることもある。これら、スーパーオキシド、過酸化水素、ヒドロキシラジカルなどに代表されるような「酸素分子に由来する反応性が高い分子群」を総称して活性酸素と呼んでいる。
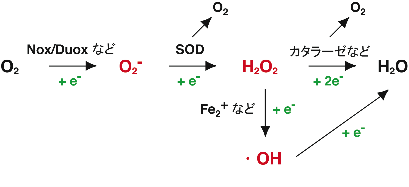
酸素呼吸を行う生物では、ミトコンドリア内膜に存在する電子伝達系(呼吸鎖)において、NADHから酸素への電子伝達が行われている。このとき、電子伝達系の最後に位置するシトクロム酸化酵素複合体の働きにより、酸素は一分子あたり四つの電子による還元を受けて水となる。しかし、この電子伝達系からは低い頻度で電子が外部に漏れ出しており、それを酸素が直接受容することで、スーパーオキシドができてしまう。つまり活性酸素は、酸素呼吸という効率的なエネルギーシステムを獲得した代償として引き受けた毒物である。細胞内には上述したSODやカタラーゼなど、活性酸素を速やかに除去するための抗酸化酵素類が存在し、呼吸に伴って常に生成し続ける活性酸素の毒性から細胞を守っている。
このように、活性酸素は「受動的に生成する毒物」と考えられてきたが、意外な事実が好中球の研究から明らかとなった。病原微生物が体内に侵入すると、好中球などの食細胞が侵入部位に集積して一次的な殺菌を行う。このとき好中球は微生物を貪食し、食胞として細胞内部に取り込んだ後、活性酸素を浴びせることによって微生物を傷害・殺菌している。この活性酸素ができる仕組みを調べてゆくと、NADPHオキシダーゼ(Nox2)という酵素が働いていることが明らかとなった。このときNADPHオキシダーゼは、NADPHから酸素分子に電子を一つ付加することでスーパーオキシドを生成している。つまり細胞内には「活性酸素を積極的につくるための酵素」が存在していることになる。
好中球における活性酸素生成は微生物を殺菌するために起こる。実際この酵素活性は微生物の貪食にリンクして厳密に調節されており、殺菌という目的のために進化した特殊なシステムと考えられていた。しかし、その後NADPHオキシダーゼに似た構造をもつ蛋白質が相次いで発見され、事態は一変する。最初に発見されたMox1(Nox1)は好中球ではなく大腸で強く発現していた。しかも、Mox1を強制発現すると細胞の増殖性が増し、またアンチセンス法によって発現抑制すると増殖性が低下した。つまりMox1による活性酸素生成は、微生物の殺菌というよりも、増殖制御など細胞自身の基本的な機能制御を担っている可能性が示唆された。現在では、これらに類似した蛋白質が数多く存在し、Nox/Duoxと呼ばれる分子ファミリーを形成していることが明らかになっている。
このようにして、細胞が活性酸素を積極的につくり、細胞の運命や機能を調節する「シグナル分子」として利用していることに注目が集まりつつある。既知のシグナル分子としては、環状AMPやCa2+などが有名であるが、いずれも特定の標的蛋白質に結合して機能を発揮している。例えば、環状AMPはAキナーゼ、Ca2+はカルモデュリン、に結合して、それぞれの蛋白質機能を変化させる。それでは活性酸素がシグナル分子として働くときの標的蛋白質はいったい何であろうか?これまでに「蛋白質チロシンホスファターゼ(PTP: protein tyrosine phosphatase)」や「チオレドキシン類縁蛋白質」などが、その候補として挙げられている。これらの蛋白質は共通して、活性酸素による可逆的な酸化によって機能が調節され、「活性酸素センサー」として働いている。ただこのような事例はまだ非常に数が限られており、新規のセンサー分子を見つけ出すことがいま重要な課題となっている。また、どのような分子が活性酸素センサーとなるのかについて、蛋白質分子の物理化学的な基盤から理解してゆく必要もある。これらの研究を推進することで、「毒物」と「シグナル分子」という二面性をもつ活性酸素の生理・病理を正確に理解し、その代謝異常に基づく疾患を適切にコントロールすることが強く求められている。
がんは1981年より日本における死亡原因の第一位となって以来、その死亡者数は増え続け、死亡原因全体の約3割を占めるに至っている。「悪性新生物」という名の示す通り、生体組織の秩序を破壊しながら増殖して個体を死に至らしめる。診断技術の進歩により早期発見の可能性が増し、新たな抗がん剤の開発が進む一方で、がん死亡率は大きく改善されていない。がん細胞は悪性化に伴い、発生した部位(原発巣)から離脱して別の組織に入り込み、さらに血管やリンパ管を介して他臓器内に侵入して転移巣を形成する。この転移現象が、がんの治療を困難にしている最大の原因であるが、その具体的なしくみは今日でもなお未解明の状態にとどまっている。そのため、転移性のがんに対して有効な治療法はほとんどなく、転移が起こるかどうかを予測する手段すら持ち合わせていないのが現状である。
がんは遺伝子DNAの異常(変異)によって起こる。このコンセプトは、特定の職業従事者に多発するがんの原因となる化学物質に関する古典的な研究や、遺伝子を傷害する放射線ががんの原因になるという事実などから確立された。1970年代より「がんの原因となる遺伝子:がん遺伝子」の探索が世界中で精力的に進められた。ヒトがんから最初に単離されたがん遺伝子Rasは、マウス培養細胞をがん細胞様に変化(形質転換:トランスフォーム)させる遺伝子として発見されている。また、このようながん遺伝子が正常な遺伝子の変異型であることが見つかり、「遺伝子が変異してがん遺伝子になる」という理解が定着した。一方、特定のタイプのがんを多発する家系の存在も知られており、その追究はp53やRbに代表される「がん抑制遺伝子」の発見につながった。これら、がん遺伝子・がん抑制遺伝子が相次いで発見されたことにより、「がんは遺伝子の病気である」というコンセプトは不動のものとなった。現在では、細胞増殖や細胞死の調節に関わるシグナル伝達因子や遺伝子修復に関わる因子をコードする複数の遺伝子に変異が蓄積することで、がんが発生・悪性化すると考えられている。
このように、がんの分子レベルでの原因究明が進み、その成果はやがて診断や治療、特に抗がん剤の開発にも大きな影響を与えるようになった。大きな成功例として、慢性骨髄性白血病の治療薬グリベックを挙げることができる。この病気は、染色体融合によりABLというチロシンキナーゼが他の蛋白質と融合したキメラ体として作られ、異常に高いキナーゼ活性を持つことによって起こる。スイスの製薬会社チバ・ガイギー(現ノバルティス)はこのキナーゼに結合してキナーゼ活性を阻害できる低分子化合物の開発に成功し、慢性骨髄性白血病の治療に革命的な進歩をもたらした。しかしその一方、グリベック以降も続々と製品化された「合理的に設計された抗がん剤」は当初期待されていたほどの大きな治療効果を示していない。特に、がんの大半を占める固形腫瘍に対して患者の生存期間を有意に延長できるような抗がん剤はほとんど存在しないのが現実である。
ところで、がんを治療困難にしている最大の原因は転移であると冒頭に述べた。この転移をくい止めることが、がん治療のもっとも重要な方策と考えられる。従来、転移性のがん細胞は原発巣において変異を蓄積・悪性化した最終段階で生じるものと考えられてきた。このような説明は、基礎的な細胞生物学の教科書にも見受けられ、医学・生物学の「常識」となっている。しかし、その実態はほとんど何も分かっていない。2008年にはマウスでの乳がんモデル実験やヒトの臨床データ解析から、転移性のがん細胞は予想されていたよりも早い時期に原発巣を離脱すると報告されており、教科書的な「常識」が揺らぎ始めている。またこのことは、「転移の有無は早い段階で既に決まっているのではないか?」「原発巣に有効な抗がん剤が転移巣にも有効なのか?」など、学術研究という枠を超えた切実な問題をも提起している。
このように、がん転移に関しては現象論レベルですら統一的な理解が存在せず、錯綜とした状況に留まっている。転移は、1:原発巣を離れて血管やリンパ管へ移動、2:血管やリンパ管内で生存、3:遠隔臓器内部へ侵入、4:遠隔臓器内部での増殖・腫瘍形成、など多段階の複雑なプロセスを経て成立する。これらのどのプロセスが転移促進に決定的な意味を持つのか、またそれはがん悪性化のどのタイミングで起こるのか、など極めて基本的な部分から明らかにしてゆく必要がある。その一方、「がんは遺伝子の病気である」ことを考えると、転移に関わる遺伝子の追究がその謎を解く上でもっとも重要な手掛かりとなることは間違いない。これまでに多くのがん遺伝子・がん抑制遺伝子が見つかったと述べたが、その多くは培養細胞の増殖性を指標としたスクリーニングで見つかっている。またヒトがんでの異常から見つかったものに関しても、それが転移に関わるのか判然としないものが大半である。そのため、がん転移との関連性が明確にされている遺伝子は数が限られているが、Prl、Kai1、NEDD9などいくつかの「がん転移遺伝子」と呼びうるものが見つかってきており、今後もこのような転移関連遺伝子の発見が続くものと思われる。2007年に登場した次世代型DNAシーケンサーは、数十年先と想像されていた個人別の全ゲノム解析を現実化しつつあり、がん転移に関わる遺伝子解析をも必然的に加速するだろう。その一方、「記号」としてリストアップされてゆく遺伝子の機能を分子・細胞・個体レベルで綿密に追究し、転移現象の科学的理解および人為的コントロールの道を開く努力が求められている。






