環境応答研究部門 生体統御分野/石谷研究室
私たちのからだは無数の細胞から構成されていますが、これらの細胞はレゴブロックのような“ただの一部品”ではありません。細胞は、隣接細胞あるいは遠隔地の細胞と情報交換を行い、種々の情報を統合処理することで各自に組織内における位置や役割を認識し、これにより適切な機能を発揮します。本分野では、このような生体を統御し、組織恒常性を支える細胞間コミュニケーションに注目し、個体の発生や再生、老化、および変性疾患の未知のメカニズム解明と、それらを基盤とした新規治療技術の開発も目指しています。
「細胞競合」の視点から、発生ロバストネスと、がんや病気の起こりのメカニズムを理解し、予防技術実現につなげる
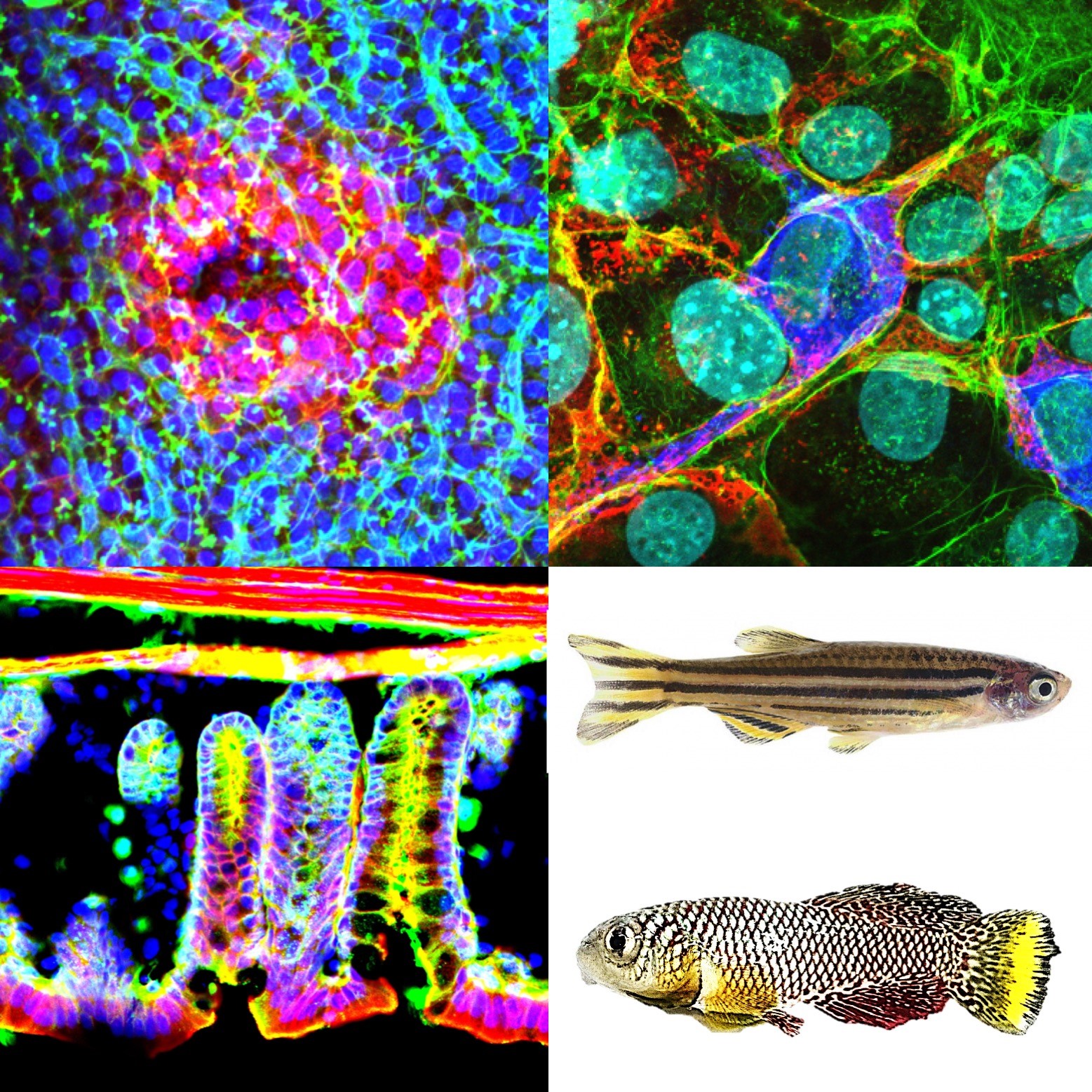
ヒトを含む多細胞生物は常に撹乱(ノイズ)にさらされています。例えば、細胞分裂の過程で複製エラーを起こしますし、代謝によって生じた活性酸素などがゲノムを傷つけることもあります。多細胞生物はこうした不可避なノイズに常に晒されており、それを何らかの方法で克服することで、再現性の高いロバストな発生・再生や恒常性維持を成し遂げているはずです。私たちは最近、「細胞競合」と呼ばれる現象がこのノイズ除去を担っていることを発見しました(Nature Communications 2019, 2022, 2024; Science Advances 2024)。細胞競合は、細胞集団内に生じたエラー細胞(病的な細胞)を細胞間コミュニケーションによって感知し、排除する仕組みです。このメカニズムが破綻すると、病的な細胞が蓄積し、不適切な場所に細胞が配置されたり(脊髄の細胞が脳にできたり)、運動機能がうまく発達しなかったり、がんが生じたり、短寿命になったりします。私たちは現在、この細胞競合のメカニズムを解明するとともに、ヒト疾患・がんの発症との関連を解析しています。そしてこの知見を利用して、病気やがんの予防技術に繋げていきたいです。
生物多様性データと超短命魚を利用して、ヒトの老化・寿命の予測・制御を狙う
もう一つの目標は老化・寿命の予測・制御です。老化を抑制できれば、あらゆる加齢性疾患の発症を抑制できるはずです。これまでの老化研究では、データをとるのに時間がかかる(ヒトの老化過程を解析すると何十年もかかり、マウスであっても3年かかる)ことがその進捗を阻んできました。私たちは最近、超短命魚キリフィッシュ(寿命3〜6ヶ月)を利用することで、短期間での老化解析を実現しました(Sci Rep 2022; NPJ Aging 2024; Science Advaces 2024)。さらに、100歳・110歳以上の長寿のヒトや、数百年生きるサメや数十年生きるコウモリなどの生物多様性データから長寿因子を探り、それをキリフィッシュに導入して健康寿命延伸物質を見つけ出す研究を進めています。さらには、健康診断で残寿命や未来の老化速度を予測する技術の確立も目指しています。
メンバー
- 教授: 石谷 太
- 助教: 龝枝 佑紀
- 助教: 阿部 耕太
- 特任助教: 石谷 閑
- 特任助教: 青木 佳南
- 日本学術振興会特別研究員: 小神野 翔平
- 日本学術振興会特別研究員: 松本かな子
ホームページ
最近の代表的な論文
- (1) Foxo3-mediated physiological cell competition ensures robust tissue patterning throughout vertebrate development. Matsumoto K. and Akieda Y., et al., Nature Commun. (2024) 15:10662
(2) Mechano-gradients drive morphogen-noise correction to ensure robust patterning. Aoki K et al., Science Advances (2024) 10:eadp2357.
(3) Sex-dependent regulation of vertebrate somatic growth and aging by germ cells. Abe K et al., Science Advances (2024) 10:eadi1621
(4) Determining zebrafish dorsal organizer size by a negative feedback loop between canonical/non-canonical Wnts and Tlr4/NFκB. Zou J, et al., Nature Commun. (2023) 14:7194.
(5) Zebrafish imaging reveals additional TP53 mutation switching oncogene-induced senescence from suppressor to driver in primary tumorigenesis. Haraoka Y., et al., Nature Commun. (2022) 13:1417
(6) Intracellular pH controls WNT downstream of glycolysis in amniote embryos. Oginuma M., et al., Nature (2020) 584(7819):98-101.
(7) Cell competition corrects noisy Wnt/β-catenin morphogen gradients to achieve robust patterning in the zebrafish embryo. Akieda Y., et al., Nature Commun. (2019)10: 4710
(8) Hipk2 and PP1c cooperate to maintain Dvl protein levels required for Wnt signal transduction. Shimizu N., et al., Cell Reports (2014) 8(5) 1391-1404
(9) Visualization and exploration of Tcf/Lef function using a highly responsive Wnt/β-catenin signaling-reporter transgenic zebrafish. Shimizu N., et al., Developmental biology (2012) 370(1) 71-85
(10) Nemo-like kinase suppresses Notch signalling by interfering with formation of the Notch active transcriptional complex. Ishitani T., et al., Nature Cell Biol. (2010) 12:278-85