バイオインフォマティクスセンター 遺伝子機能解析分野/伊川研究室
ヒトやマウスのゲノムプロジェクトが一応の完了を迎えた現在、蓄積されたデータをもとに、遺伝子の機能を生体レベルで解析し得るツールが疾患研究や基礎生物学研究に重要な役割を果たしています。遺伝子機能解析分野では、ゲノム編集や生殖・発生工学を駆使した遺伝子解析ツールを開発すると同時に、それらを応用したユニークなアプローチから個体レベルでの生殖生物学研究を行っています。
最先端の遺伝子組換え技術を活用した生殖生物学研究
私たちはゲノム編集などの最新遺伝子改変技術を活用して、配偶子形成や受精、胎盤形成などに関わる様々な分子の機能や役割を研究し、生命の根源である生殖の深遠なる謎を解き明かすべく研究を行っています。
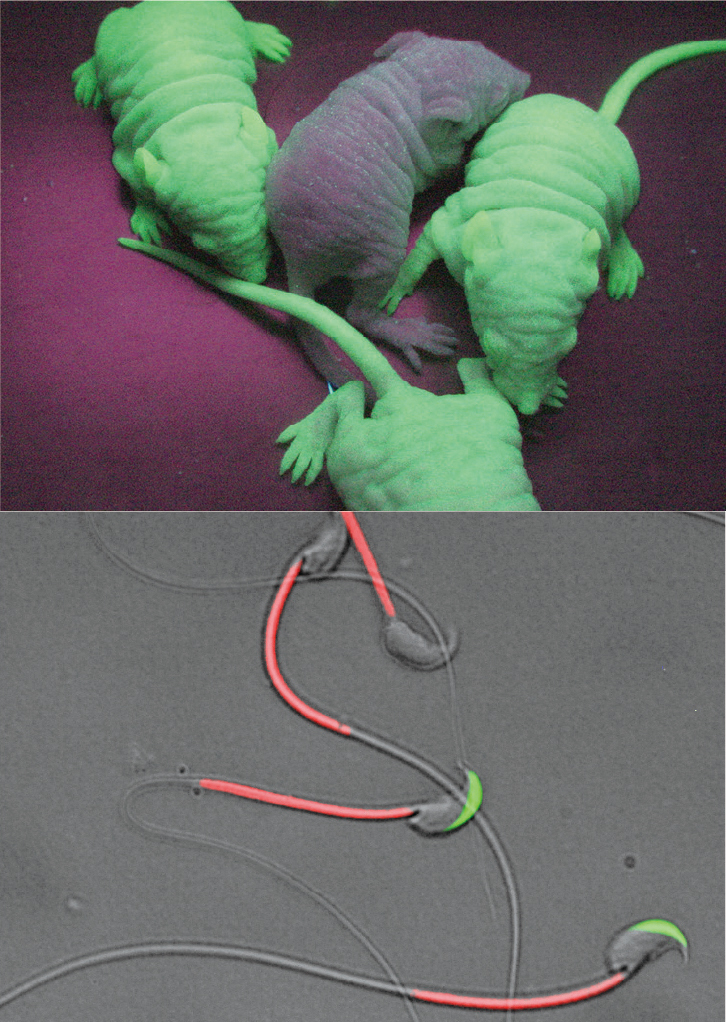
私たちが世界に先駆けて作製したGFP遺伝子を発現するグリーンマウスやそのノウハウは、受精のメカニズムや生殖細胞の成り立ち解明に大きく寄与してきました(図1)。GFPやDsRedなどの蛍光タンパク質で可視化した生殖細胞を用いたイメージング解析は、交尾後の精子の動きや局在、受精の瞬間をリアルタイムで捉えることを可能にします(図2)。
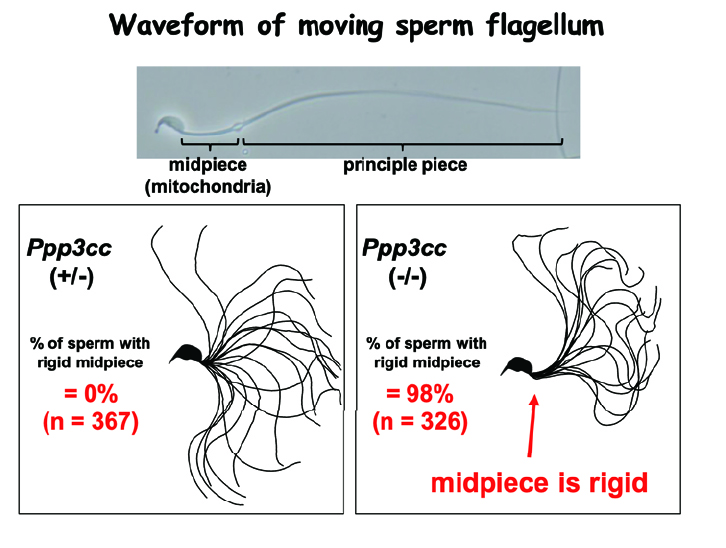
興味深いことに、精巣で作られた直後の精子には卵と受精する能力がなく、精巣上体を通過する間に受精できるようになります。私達はゲノム編集マウスを用いた解析から、精巣上体における精子成熟に関して興味深い知見を得ることができました。1つ目は、精巣から精巣上体の分化を促す因子が管腔を通って送られているというルミクラインの解明です。私達は、精巣で作られたNELL2が管腔を通って精巣上体に移動し、ROS1受容体を介して精巣上体の上皮細胞分化を誘導、分化した上皮細胞から作られたOVCH2プロテアーゼが精子表面のADAM3膜タンパク質のトリミングを介して、精子の受精能力を制御している一連の過程を明らかにしました。40年来の謎であった、ルミクライン現象を分子レベルで証明したことになります(論文3)。また、精子が正常に運動するために必須の脱リン酸化酵素として精子カルシニューリンを同定しました。精子カルシニューリンを欠損したマウスでは、精子の尾部の中片部というごく一部の運動性が悪くなり、卵子を覆う透明帯を通過できず受精できないことがわかりました。男性不妊症の診断に役立つとともに、精子カルシニューリンを特異的に阻害する薬剤は、男性経口避妊薬の開発にもつながることが期待されます(論文6、図3)。
私達は精子と卵の相互作用についても長年研究を続けています。卵との融合に必須な膜タンパク質としてIZUMO1を2005年にNatureに発表していますが、雄性不妊となるゲノム編集マウスを数多く調べることで、SOF1, TMEM95, SPACA6, DCST1/2など、新たな必須因子を見つけることに成功しました(論文4,5)。現在は、これらの因子群が、どのように精子と卵の融合に関わるのかを研究しています。
生物・医学研究のためのツール・技術の開発
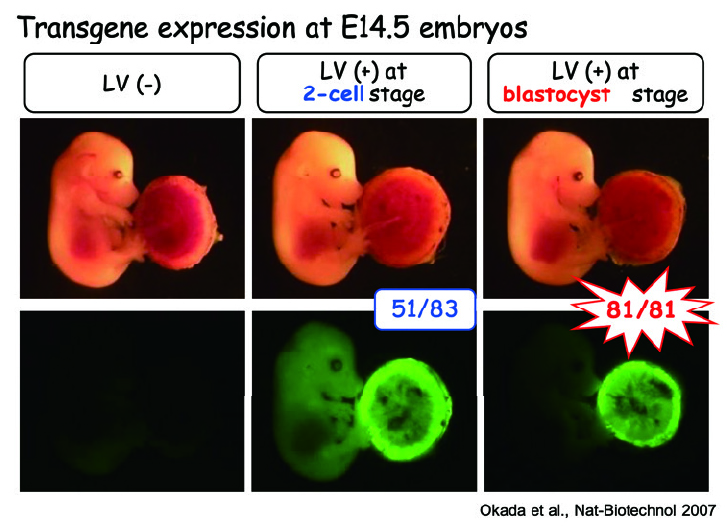
各種ウィルスベクターや組織培養チップを用いた新しい生殖研究ツールや生殖補助技術の開発も行っています。例えばレンチウイルスベクターを用いて胎盤にのみ遺伝子操作することで、妊娠高血圧症候群のモデルマウス開発にも成功しました。最近はアデノウイルスベクターやLNP (Lipid NanoParticle)を用いて一過性に遺伝子発現するメリットを生かした研究も行っています。またガス透過膜と多孔膜を組み合わせて精巣を培養することで、試験管内で精子形成を再現して観察することにも成功しました。最近は、着床の再現にも成功しており、これらを組み合わせて、生殖メカニズム解明や生殖補助技術開発に繋げています。
これらの最先端の遺伝子組換え技術を、学内のみならず学外にも広く公開し、感染動物実験施設と協力して多くの研究者にトランスジェニックマウス、ノックアウトマウス、ゲノム編集マウスの作製支援を行っています。
研究・支援に関する最新情報については、HPをご覧ください。
-
図1(上):緑に光る蛍光タンパク質GFPを発現するマウス。全身の細胞が緑に光るため、生殖研究のみならず様々な生物学的研究に活用されている 図2(下):蛍光タンパク質により可視化した精子。精子の挙動や先体反応の瞬間をリアルタイムで捉えることができる
-
図3:精子カルシニューリンを欠損したマウス精子。鞭毛中辺部の動きが少しおかしくなるだけで運動性が低下して雄性不妊となる
-
図4:レンチウイルスベクターを用いた胎盤特異的な遺伝子操作法。透明帯があるとウイルスは感染できないが(左)、透明帯を除去した受精卵に感染させると胎児と胎盤の両方に(中)、同じく胚盤胞期胚に感染させると胎盤特異的に遺伝子導入できる(右)
メンバー
- 教授: 伊川 正人
- 准教授: 宮田 治彦
- 助教: 江森 千紘
- 助教: 増子 大輔 (兼)
- 助教: 畑中 勇輝 (兼)
- 特任助教: 飯田 理恵 (兼)
- 特任助教: 石川 祐
- 特任助教: 藤内 慎梧(兼)
- 特任研究員: 大浦 聖矢
ホームページ
最近の代表的な論文
1) TEX38 localizes ZDHHC19 to the plasma membrane and regulates sperm head morphogenesis in mice. Kaneda Y. et al., PNAS (2025) 10.1073/pnas.2417943122
2)A small secreted protein NICOL regulates lumicrine-mediated sperm maturation and male fertility. Kiyozumi D. et al., Nat. Commun. (2023) 10.1538/expanim.23-0055
3)TSKS localizes to nuage in spermatids and regulates cytoplasmic elimination during spermiation. Shimada K. et al., PNAS (2023) 10.1073/pnas.2221762120
4) 1700029I15Rik orchestrates the biosynthesis of acrosomal membrane proteins required for sperm–egg interaction. Lu Y. et al., PNAS (2023) 10.1073/pnas.2207263120
5) Testis-enriched ferlin, FER1L5, is required for Ca2+-activated acrosome reaction and male fertility. Morohoshi A. et al., Science Adv. (2023) 10.1126/sciadv.ade7607
6) Human sperm TMEM95 binds eggs and facilitates membrane fusion. Tang S., Lu Y. et al., PNAS (2022) 10.1073/pnas.2207805119
7)NELL2-mediated lumicrine signaling through OVCH2 is required for male fertility. Kiyozumi D. et al. Science. (2020) 10.1126/science.aay5134
8)Sperm calcineurin inhibition prevents mouse fertility with implications for male contraceptive. Miyata H. et al., Science. (2015) 10.1126/science.aad0836