研究内容
複製複合体の形成機構
プラス鎖RNAウイルスの多くは、感染後期過程に宿主細胞内膜系を大規模に再構築し、複製オルガネラ、又は「membranous web」と呼ばれる新規オルガネラをつくります。その構造体は小胞体(ER)近傍に形成され、そこでウイルスゲノムの複製と粒子形成が行われています。この複製オルガネラ形成は、様々な細胞内ストレス応答からの回避を可能にし、長期間にわたり自身の遺伝子を複製させるために必須な構造物であると考えられています。私たちは、ウイルスが細胞質に新規オルガネラを形成し細胞内に「巣食う」分子機構を明らかにすることを目的として研究を進めています。最近、私たちはC型肝炎ウイルス(HCV)及びフラビウイルス感染細胞内のウイルス複製オルガネラを精製し定量プロテオミクス解析を行い、感染によって特異的にリクルートされてくる宿主因子群を多数同定しました。私たちは、これら宿主因子群が、どのようにウイルス複製オルガネラ形成の開始と維持に寄与しているか明らかにし、新たな宿主—病原体の相互依存関係を検索することによって、ウイルスと宿主細胞が共生することを可能にさせる分子機構の解明を目指しています。
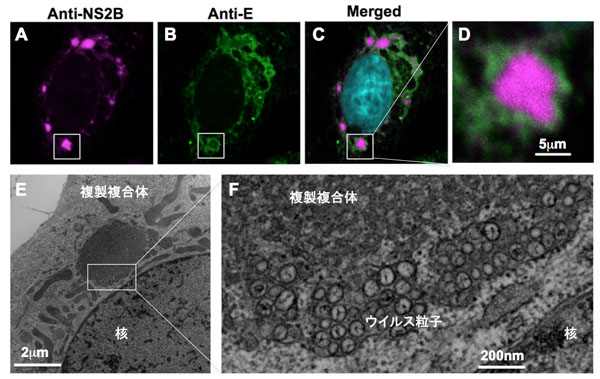
図:ウイルス複製複合体 フラビウイルス感染Vero細胞の蛍光顕微鏡像(A-D)と電子顕微鏡像(E,F)。ウイルス感染24時間後に細胞を固定し非構造蛋白質抗体(anti-NS2B、マゼンダ)、構造蛋白質抗体(anti-E、グリーン)抗体およびDAPI(シアン)で染色した。感染細胞では核のそばに直径5-10mmの生体膜で囲まれたウイルス抗原陽性の構造体が検出される。複製複合体の周縁部には小胞体様構造があり、内部にウイルス様粒子の蓄積が観察された。
プラス鎖RNAウイルスの多くは、感染後期過程に宿主細胞内膜系を大規模に再構築し、複製オルガネラ、又は「membranous web」と呼ばれる新規オルガネラをつくります。その構造体は小胞体(ER)近傍に形成され、そこでウイルスゲノムの複製と粒子形成が行われています。この複製オルガネラ形成は、様々な細胞内ストレス応答からの回避を可能にし、長期間にわたり自身の遺伝子を複製させるために必須な構造物であると考えられています。私たちは、ウイルスが細胞質に新規オルガネラを形成し細胞内に「巣食う」分子機構を明らかにすることを目的として研究を進めています。最近、私たちはC型肝炎ウイルス(HCV)及びフラビウイルス感染細胞内のウイルス複製オルガネラを精製し定量プロテオミクス解析を行い、感染によって特異的にリクルートされてくる宿主因子群を多数同定しました。私たちは、これら宿主因子群が、どのようにウイルス複製オルガネラ形成の開始と維持に寄与しているか明らかにし、新たな宿主—病原体の相互依存関係を検索することによって、ウイルスと宿主細胞が共生することを可能にさせる分子機構の解明を目指しています。

図:ウイルス複製複合体 フラビウイルス感染Vero細胞の蛍光顕微鏡像(A-D)と電子顕微鏡像(E,F)。ウイルス感染24時間後に細胞を固定し非構造蛋白質抗体(anti-NS2B、マゼンダ)、構造蛋白質抗体(anti-E、グリーン)抗体およびDAPI(シアン)で染色した。感染細胞では核のそばに直径5-10mmの生体膜で囲まれたウイルス抗原陽性の構造体が検出される。複製複合体の周縁部には小胞体様構造があり、内部にウイルス様粒子の蓄積が観察された。
ウイルス粒子形成
レトロウイルスやラブドウイルスといった多くのRNAエンベロープウイルスは共通して、宿主細胞のMultivesicular Body (MVB)というリソソームを介した細胞内膜蛋白質分解経路をウイルス粒子形成に利用していることが知られ、この生体膜切り離しを伴う膜構造変化のプロセスは、ESCRT (Endosomal Sorting Complex Required for Transport)と呼ばれる因子群によって制御されていることがわかっています(Morita, E., Sundquist, WI. Annu Rev Cell Dev Biol., 2004)。ESCRTを介した膜切り離しでは、ESCRT-IとALIXと呼ばれる因子群がウイルスコア蛋白によって膜狭窄部位にリクルートされた後、最終的にCHMP (Charged MVB Proteins) ファミリーというESCRT-III因子群がフラメント状にアセンブリし多重リング様構造を形成しながら膜内側で集積します。このCHMPファミリーの集積とその後の複合体構造変化が、生体膜切り離しのダイナミズムに深く関与していると考えられています。HCVなどのプラス鎖RNAウイルスの粒子形成においても、同じシステムが利用されているという報告が存在するが、その詳細については未だ不明です。私たちは、HCVをはじめフラビウイルスなどのプラス鎖RNAウイルスの粒子形成時における生体膜ダイナミクスの分子機構を明らかにすることを目的とし研究を行っています。単なるESCRT経路の関与のみの解析ではなく、新たな宿主因子検索のためのプロテオミクス解析も同時に行い、ウイルス粒子形成時におけるウイルス因子と細胞因子の相互作用ネットワークの全体像を明らかにしようと試みています。
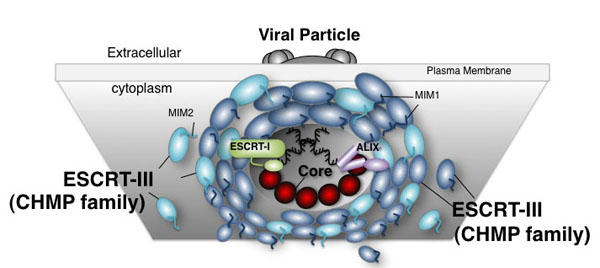
図:ESCRTを介したエンベロープウイルス粒子形成のモデルESCRT-IIIフィラメントが膜狭窄部位周辺にリング状に集積し、蛋白質構造変化とESCRT-IIIの再編成が起こり、膜切り離しが誘導されると考えられている。
レトロウイルスやラブドウイルスといった多くのRNAエンベロープウイルスは共通して、宿主細胞のMultivesicular Body (MVB)というリソソームを介した細胞内膜蛋白質分解経路をウイルス粒子形成に利用していることが知られ、この生体膜切り離しを伴う膜構造変化のプロセスは、ESCRT (Endosomal Sorting Complex Required for Transport)と呼ばれる因子群によって制御されていることがわかっています(Morita, E., Sundquist, WI. Annu Rev Cell Dev Biol., 2004)。ESCRTを介した膜切り離しでは、ESCRT-IとALIXと呼ばれる因子群がウイルスコア蛋白によって膜狭窄部位にリクルートされた後、最終的にCHMP (Charged MVB Proteins) ファミリーというESCRT-III因子群がフラメント状にアセンブリし多重リング様構造を形成しながら膜内側で集積します。このCHMPファミリーの集積とその後の複合体構造変化が、生体膜切り離しのダイナミズムに深く関与していると考えられています。HCVなどのプラス鎖RNAウイルスの粒子形成においても、同じシステムが利用されているという報告が存在するが、その詳細については未だ不明です。私たちは、HCVをはじめフラビウイルスなどのプラス鎖RNAウイルスの粒子形成時における生体膜ダイナミクスの分子機構を明らかにすることを目的とし研究を行っています。単なるESCRT経路の関与のみの解析ではなく、新たな宿主因子検索のためのプロテオミクス解析も同時に行い、ウイルス粒子形成時におけるウイルス因子と細胞因子の相互作用ネットワークの全体像を明らかにしようと試みています。

図:ESCRTを介したエンベロープウイルス粒子形成のモデルESCRT-IIIフィラメントが膜狭窄部位周辺にリング状に集積し、蛋白質構造変化とESCRT-IIIの再編成が起こり、膜切り離しが誘導されると考えられている。
感染とオートファジー
フラビウイルスなどのプラス鎖RNAウイルスは感染すると宿主細胞のオートファジー機構を誘導するといわれています。しかし、誘導されるオートファゴソームは不完全なもので、これまでに報告されている選択的オートファジーとは異なった性質を持つことが示されており、オートファゴソーム誘導の生理学的意義やその分子機構は未だ多くの謎に包まれています。
私たちは、HCVおよび同科のフラビウイルスを材料に用い、1)ウイルス感染によるオートファジー誘導の生理学的意義、2)ウイルス感染によるオートファジー誘導の分子機構、3)ウイルスのオートファジー回避機構、の3つのテーマについて解析を進め、難治性又は新興・再興ウイルス性疾患の制御法開発に繋がる分子基盤の確立を目指しています。
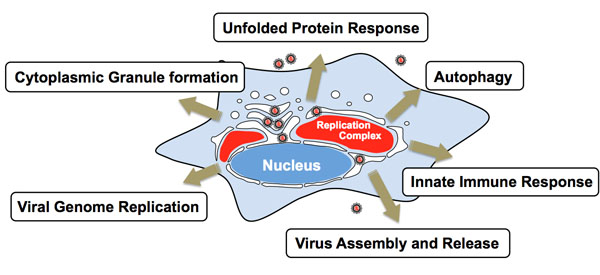
フラビウイルスなどのプラス鎖RNAウイルスは感染すると宿主細胞のオートファジー機構を誘導するといわれています。しかし、誘導されるオートファゴソームは不完全なもので、これまでに報告されている選択的オートファジーとは異なった性質を持つことが示されており、オートファゴソーム誘導の生理学的意義やその分子機構は未だ多くの謎に包まれています。
私たちは、HCVおよび同科のフラビウイルスを材料に用い、1)ウイルス感染によるオートファジー誘導の生理学的意義、2)ウイルス感染によるオートファジー誘導の分子機構、3)ウイルスのオートファジー回避機構、の3つのテーマについて解析を進め、難治性又は新興・再興ウイルス性疾患の制御法開発に繋がる分子基盤の確立を目指しています。
