多細胞生物を構成する一つ一つの細胞は、置かれた環境(ホルモン・増殖因子などの刺激物質、周囲の細胞や間質との相互作用など)に適切に応答するためのシグナル伝達システムを有している。その破綻は、がん細胞に典型的に観察されるような周囲との調和を逸脱した無秩序な細胞増殖など、さまざまな疾患の原因となる。私たちの研究室では、細胞の増殖、分化、運動など、さまざまな細胞現象を制御するシグナル伝達の仕組みについて、分子・細胞レベルから線虫やマウスを用いた生物個体レベルで包括的な解析を進めている。特に現在は、(1) 蛋白質の可逆的な酸化修飾による酸化ストレス応答シグナル伝達、(2) 細胞内マグネシウムの制御とシグナル伝達制御、の二点を主要な研究課題として取り組んでいる。
(1) 蛋白質の可逆的な酸化修飾による酸化ストレス応答シグナル伝達
多細胞生物の初期発生や発がんなどに重要なWntシグナル伝達の新規制御因子として、チオレドキシン類縁蛋白質のヌクレオレドキシン(NRX: nucleoredoxin)を見つけた。NRXはWntシグナル伝達に必須のDishevelled(Dvl)に結合して、その機能を抑制する働きをもつ。その一方で、このNRX-Dvlの結合は、NRXの分子内S–S結合の形成による可逆的な酸化によって制御されていることも明らかとなった。つまり、NRXはレドックス状態応答性にWntシグナル伝達を調節する機能を担っている。また、チオレドキシンを利用して、細胞内でS–S結合を形成する蛋白質を網羅的に探索する実験系を開発した。それを用いて、新規S–S蛋白質としてセマフォリンシグナル伝達に働くCRMP2などを見つけている。セマフォリン刺激応答性に過酸化水素が産生され、それがCRMP2を酸化してS–S結合で結ばれたホモ二量体を作らせることを明らかにした。この可逆的なCRMP2酸化がセマフォリン刺激による軸索反発応答を仲介していることを発見した(Fig. 1)。
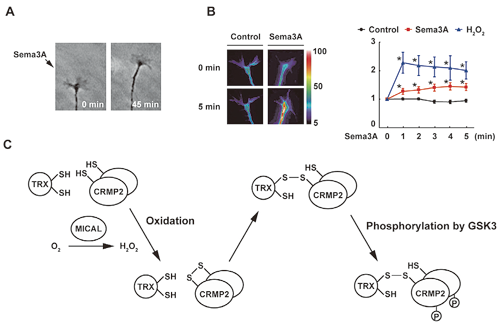
Fig. 1: CRMP2 oxidation in Semaphorin signaling
(A) Repulsive guidance of axons by Semaphorin 3A (Sema3A). (B) Increase of H2O2 in growth cones of neurons by Sema3A. (C) Schematic illustration of the mechanism of Semaphorin signaling via CRMP2 oxidation. Sema3A stimulation generates H2O2 and oxidizes CRMP2. Oxidized CRMP2 transiently forms protein complexes with TRX, which induces CRMP2 phosphorylation by GSK3.
(2)細胞内マグネシウムの制御とシグナル伝達制御
細胞内でS–S結合を作る蛋白質として、チロシンホスファターゼドメインを持つ機能未知分子PRLを見つけた。PRLは悪性度の高いがんで高発現しており、がん転移を促すことが知られている。私たちはPRLの結合蛋白質の探索を行い、Magnesium-Exporting protein(MagEx)と呼ぶ膜蛋白質を同定した。MagExはMg2+を排出することで細胞内Mg2+の制御を行っており、PRLとの結合によってその機能が抑制された。この結合はPRLの酸化還元状態依存性に起こっており、PRLは細胞内マグネシウム量を調節していることが明らかとなった。また、個体レベルにおいて、内在性MagExは腸の上皮細胞に強く発現しており、その細胞膜の基側部に局在していた。MagExの遺伝子欠損マウスを作製したところ、腸からのマグネシウム吸収が大きく妨げられていた。さらに、MagExは歯のエナメル質を作る上皮細胞(エナメル芽細胞)にも強く発現し、MagEx遺伝子欠損マウスではエナメル質形成不全が生じていた(Fig. 2)。MagExによるMg2+排出が全身や局所におけるマグネシウム量の適切な制御に重要であり、その異常がさまざまな疾患の原因になっていることが明らかになってきた。
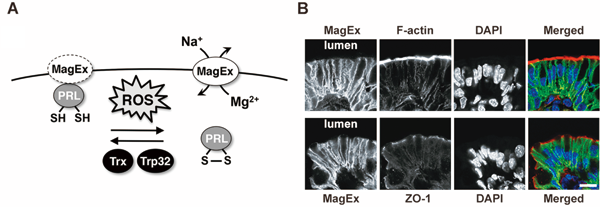
Fig. 2: Redox regulation of the intracellular Mg2+ level by MagEx
(A) MagEx stimulates Na+/Mg2+-exchange and decreases the intracellular Mg2+ level. PRL directly binds to MagEx and inhibits its Mg2+-transporting function in a manner dependent on its redox state. Oxidized PRL is reversibly reduced by S–S bond-reducing enzymes, such as Trx and Trp32. (B) Localization of endogenous MagEx at the basolateral membrane of the epithelial cells in the intestine.