世界人口の約4割がマラリア流行地域に居住し、年間におよそ200万人が死亡するため、マラリアは人類最大の敵と呼ばれている。また、流行地域の全域において、薬剤耐性マラリアが出現しており、マラリア対策が困難になりつつある。従って、ワクチンや抗マラリア薬剤の開発は緊急の研究課題である。当研究分野ではマラリアワクチンの開発を行うとともに、分子細胞生物学的手法を用いて、マラリア原虫の寄生適応戦略の解析を行っている。
(1)組換えSERA蛋白質によるマラリアワクチンの開発
我々はこれまでに熱帯熱マラリア原虫のSERA5(Serine Repeat Antigen, 120kD)抗原分子に着目してワクチン開発を進めてきた(文献1, 2)。ウガンダのマラリア高度流行地域に住む児童を対象として疫学調査を行った結果、SERA5のN-末端ドメインに対する抗体価を持つ児童は全く発熱をしておらず、児童の血中マラリア原虫率と抗SERA-IgG抗体価に極めて明瞭な負の相関関係が認められた。組換えSERA5のN-末端ドメインタンパク質、SE36、と水酸化アルミニウムゲルを混合したマラリアワクチン臨床治験製剤(BK-SE36)を(財)阪大微生物病研究会と協力して生産し、2010年から2011年にかけてウガンダにおいて140名の披験者が参加した第Ib相臨床試験を実施した。成人男女を対象としたステージ1で安全性を確認し、その後に6-20歳の若年層を対象としたステージ2でさらに安全性を確認した。これらの接種者をその後1年間にわたってマラリア感染の状況を観察した結果、ワクチンを接種しなかった対照群に比べて72%(p=0.003)の発症防御効果を確認した(文献2)。マラリアワクチンの開発を困難なものとしている主たる理由は抗原遺伝子の多型性にあるが、SERA遺伝子は抗原変異を示さず抗原多型も極めて少なく(文献4)、広く効果が期待できる。今後さらに高次の臨床試験を実施して流行地域で利用されるワクチンの開発を進める。

図1:ウガンダ北部アパッチにある病院の |
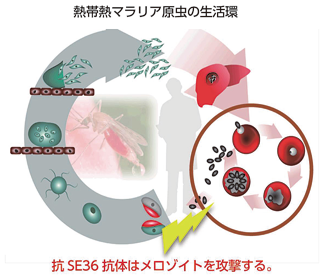 図2:SE36マラリアワクチンによって誘導された 抗SERA抗体によるマラリア原虫殺滅の作用点 |
 図3:SE36マラリアワクチン治験製剤: (財) 阪大微生物病研究会観音寺研究所に おいてGMP条件を遵守して生産された。 |
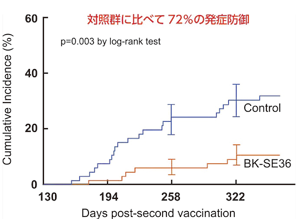
図4:Kaplan-Meierプロットによるワクチン接種群、 |
(2)マラリア原虫の進化過程の解明
マラリア原虫は、複雑な生活環、宿主免疫応答の回避機構、宿主特異性など、ユニークな特徴を数多く有する。これらの基盤となる分子機構を明らかにするために、核ゲノム、オルガネラゲノムの解読や抗原分子の多型解析など、遺伝子配列情報からのアプローチを行っている(文献4,5)。これらの研究からの成果はワクチン開発の現場でも有効に利用されている。
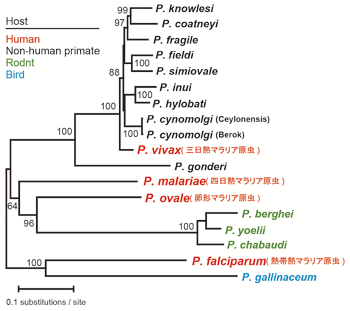
図5:アピコプラストゲノムコードの30遺伝子による系統樹:
ヒトを宿主とする4種のマラリア原虫は単系統群を形成しない。
宿主転換が進化の過程において何度も生じている。