
微生物病研究所 分子免疫制御分野
Department of Molecular Immunology
Research Institute for Microbial Disease
Osaka University



T細胞は抗原提示細胞上のMHC分子によって提示された抗原分子を認識し、ヘルパーT細胞やエフェクターT細胞へと分化する。一方、抗原刺激とヘルパーT細胞の補助の下、B細胞は抗体産生細胞や記憶B細胞に分化する。このようなリンパ球の分化過程にはT細胞・抗原提示細胞間及びT細胞・B細胞間の物理的な相互作用が必須であり、これら相互作用はCD40、CD40リガンド、B7、CD28等の補助刺激分子によって担われている。また最近、セマフォリンファミリーに属する分子が、種々の免疫応答において重要な役割を果たしていることが明らかになってきた。当研究分野では、これら免疫制御分子による免疫反応の調節機構を解析している。
a) 免疫セマフォリンによる免疫制御機構:
セマフォリンファミリー分子は神経の軸策に対して化学反発活性や化学誘因活性を発揮し、その伸長方向を決定する神経軸索ガイダンス因子として知られているが、当分野の研究から、数種類のセマフォリン分子が免疫反応の様々なステップで機能していることが明らかになっており、新たな免疫制御分子ファミリー(免疫セマフォリン)が形成されつつある(図1)。例えば、Sema4DはB細胞の活性化や恒常性維持に寄与するとともに、樹状細胞の活性化を介して細胞性免疫の調節にも関与している。一方、Sema4Aは直接T細胞に働いて、T細胞のプライミングやTh1分化に重要な役割を果たす。また、Sema6Dとその受容体Plexin-A1の相互作用は、樹状細胞の活性化、破骨細胞の分化誘導に必要である。更に、活性化T細胞上のSema7Aがα1-integrinを介してマクロファージを刺激して、炎症反応の引き金を引くことも明らかになっている(図2)。
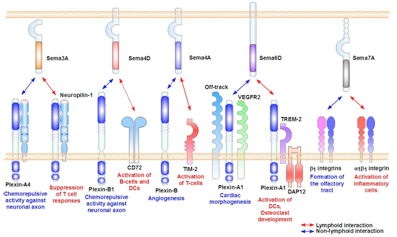
図1.代表的な免疫セマフォリン
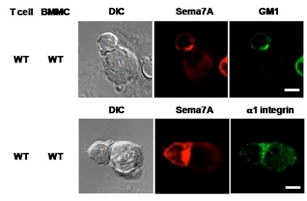
図2.T細胞‐マクロファージ間直接相互作用におけるSema7Aとα1 integrinの免疫シナプスへの凝集
b) B細胞分化・生存制御の分子機構:
B細胞は外来抗原に対して効果的な抗体を産生するために抗体産生細胞や記憶B細胞に分化するが、その際にB細胞表面上のB細胞抗原レセプターやCD40、BAFF-Rに代表されるTNFレセプターファミリーからの刺激を必要とする。これらのシグナル伝達経路に関与する分子機能が当分野の研究により明らかになるにつれ、液性免疫成立機構とその脆弱性による免疫病態の発症機構が解明されてきた。特に、CD40、BAFFR細胞内領域に会合するTRAF3分子が、B細胞の生存に必須であることが明らかとなるとともに、TRAF3会合分子であり、かつB細胞抗原レセプターシグナルの下流に存在するPKCファミリー分子、PKN1がAktのネガティブ制御分子として作用し、自己反応性B細胞除去等の免疫寛容成立に必要であることも最近見出されてきた。
免疫反応の成立・調節の分子機構
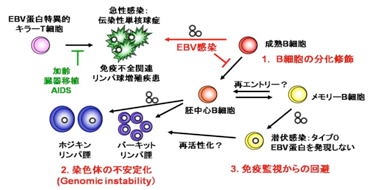
図3.EBVと宿主免疫システム
EBVの形質転換機構と感染成立機構は免疫システムの脆弱性と密接に関連している。1.B細胞分化修飾(宿主免疫細胞生存シグナルの模倣)2.染色体の不安定化3.免疫監視からの回避(潜伏感染遺伝子の完全不活性化)
a) EBV潜伏感染遺伝子による免疫応答修飾機構:
EBV潜伏感染遺伝子産物の中でLatent membrane protein 1(LMP1)は、B細胞においてCD40シグナルを模倣し、恒常的活性化をもたらす。当研究分野ではトランスジェニックマウスを用いて、LMP1が高親和性抗体産生細胞や記憶B細胞分化に必須である胚中心形成を阻害することによってEBV感染成立に寄与していることを明らかにしてきた。現在、さらにB細胞抗原レセプターシグナルを恒常的に活性化するLMP2aといった膜蛋白からのシグナル、及びNotchシグナルを模倣するEBNA2に焦点をおき、それらウイルス分子に利用される宿主因子のB細胞生存、分化における生理的意義、形質転換への関与を解析している。
b) EBV感染成立の分子機構:
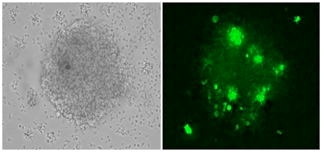
図4.GFP遺伝子を有するリコンビナントEBVによるヒト末梢血B細胞の不死化
Epstein-Barrウイルス-宿主間相互作用による免疫病態発症の分子機構


