正常組織・臓器/器官の構築においては、組織特異的幹細胞による組織細胞の産生が必須であるが、同時にこの幹細胞を中心とした、組織環境の構築がこれら幹細胞システムを維持していく上では重要である。組織環境の要素として、基本骨格をなすのが血管であり、血管構築がなければほとんどの臓器・器官の形成は阻害される。我々の研究室では、このような正常臓器・器官における血管新生と組織幹細胞の幹細胞性の維持機構についての分子機構を解明し、特に病態形成との関わりにおいては腫瘍に注目して、がん幹細胞の発生/増殖/維持のメカニズムと、それを支持する生態学的適所(ニッチ)を解析し、がんを根治する治療法の開発を行っている。研究は大きく分け以下の2項目により実施している。
I. 正常組織およびがん組織における血管リモデリングの分子機序の解明
1) 発芽的血管新生の分子メカニズム (Tie1, Tie2受容体の活性化、不活性化の分子機構)
2) 血管幹細胞の発生と生理的/病的血管形成との関連
3) 血管成熟化および動静脈パターニングの解明(ephrinB2/EphB4、apelin/APJ)
4) 血管制御によるドラッグデリバリーシステムの構築
II. がん幹細胞および正常組織幹細胞の組織内維持機構の解明
1) 幹細胞へのリプログラミング機構の解析
2) 幹細胞の分裂を制御するDNA複製因子GINSおよびGalectin-3の機能制御
3) がん幹細胞維持にかかわるニッチ構成細胞の同定とニッチの破綻
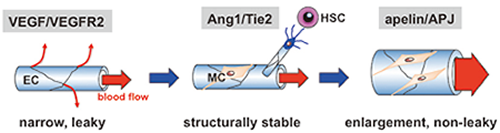
図1 血管の成熟化機構
種々の血管病の治療において血管成熟化のインパクトは大きい。我々は壁細胞 (MC)が分泌するangiopoietin-1(Ang1)は血管内皮—壁細胞間接着を誘導して構造的に安定な血管形成を誘導する概念を導きだした(Takakura, Immunity 1998)。また造血幹細胞 (HSC) 由来Ang1は血管新生を誘導しつつ(Takakura, Cell 2000)、新生血管の透過性を抑制することを見いだした(Yamada, J Exp Med 2006)。血管新生の過程で内皮細胞上のTie2の活性化によりapelinが分泌され、血管径の太い、透過性の抑制された血管が形成される(Kidoya, EMBO J 2008, Blood 2000)。そしてapelinを腫瘍で過剰に発現させると、腫瘍血管が成熟化し、薬剤送達性を改善するなど、他の癌治療の効果を高めることを見いだした(Kidoya, Oncogene 2012)。
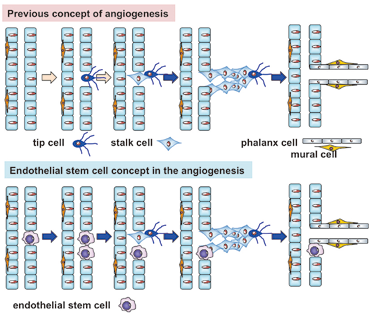
図2 血管新生と血管内皮幹細胞
血管新生の過程では、発芽した血管の先頭を移動してガイダンスとして機能するtip細胞、その背後から増殖して血管伸長に関わるstalk細胞、そして最後に壁細胞化を伴う成熟した血管に分化させるphalanx細胞という、少なくとも3種の内皮細胞が存在することが明らかにされてきた。我々は内皮細胞の中に幹細胞様細胞を発見したことに立脚し (Naito, EMBO J 2012)、このような内皮細胞の異種性細胞分化における幹細胞システムの生理的および病的意義を解明している。
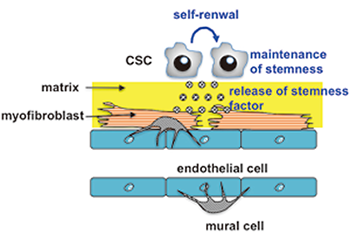
図3 がん幹細胞の血管ニッチ
我々は、自己複製中の幹細胞に共通して発現するDNA複製因子、PSF1の発現を利用してがん幹細胞(CSC)を捉え(Nagahama, Cancer Res 2010)、CSCが腫瘍内成熟血管を生態学的適所(ニッチ)としていることを解明した (Matsui, Am J pathol 2013)。そして血管ニッチにおける、がん幹細胞の幹細胞性維持にCD44が関与していることを見いだした(Kinugasa, Stem Cells 2014)。