「がん」は、ゲノムに生じる様々な変異を引き金として発生し、進化し、そして悪性化する。その過程において、「がん抑制遺伝子」の機能欠損変異による細胞の不死化や、「がん原遺伝子」の活性化変異(「がん遺伝子」への変異)による細胞形質の大きな転換が生じる。不死化によってがん防御機構としてのアポトーシスや老化が回避され、形質転換によって自律的増殖能の獲得、細胞間コミュニケーションの破綻、細胞形態の変化、基質分解酵素や増殖因子の分泌亢進、浸潤・転移能の獲得などのがん悪性化形質が誘導される。当研究室では、後者の形質転換に関わる「がん原遺伝子」の本来の生理機能と制御機構をまず理解し、その活性化変異によるがん形質発現の分子基盤の解明と新たながん治療標的の開拓を目指した研究を進めている。これまでに、ヒトのがんとも深く関わるチロシンキナーゼ型がん原遺伝子c-Srcの発生・分化・組織構築などにおける生理機能、およびその調節機構を明らかにしてきた。現在は、がん化モデル細胞や実際のヒトがん細胞などを用いて、c-Srcによるがん悪性化の細胞内経路とその制御機構の全容解明を目指した研究を進めている。
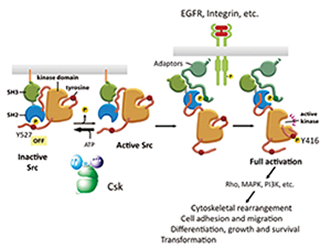 |
図1. c-Srcの機能と活性制御機構 |
I. c-Srcの機能と制御機構
正常細胞では、c-Srcは特異的な制御因子Cskによってリン酸化された不活性型で存在し、増殖因子や細胞外マトリックスなど多様な細胞外刺激に応答した時に活性化する。その下流で、MAPK経路などの活性化を介して遺伝子の発現を誘導したり、Rho GTPaseを活性化して細胞骨格の再編を誘導する。その結果、細胞接着・運動能の活性化、分化、増殖、生存、さらには形質転換の誘導など多様な生理機能を発揮する(図1)。ヒトのがんではc-Src遺伝子自体には変異は検出されていないが、様々ながん細胞でSrcの蛋白量や活性が上昇していることが認められている。その増大したキナーゼ活性によってSrcの多様な機能が増幅されてがん悪性化形質が誘導されると考えられている。近年我々は、c-Srcのがん化能が、細胞膜ミクロドメインに存在する膜アダプタータンパク質Cbpによって制御されることを見出し、その制御システムの破綻とがん化との関連性について解析を進めている。
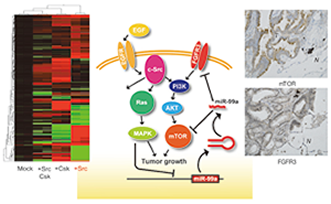 |
図2. miRNAを介するSrcによるがん形質発現制御機構 |
II. c-Srcによるがん形質発現機構の解析
c-Srcによるがん形質発現に至る細胞内経路を特定するために、独自に開発したc-Srcによるがん化誘導系を用いて網羅的な解析を進めている。プロテオミクス解析から、新たなSrc下流因子としてRhoの活性化を誘導するArhgef5を同定し、そのKOマウス作製等により機能解析を進めている。また、miRNAのアレイ解析からは、c-Srcによるがん化形質の発現に伴って比較的限られた種類のmiRNAの発現が変動することを見いだし、それらの標的遺伝子を複数種同定することに成功している。それら主要な標的遺伝子がc-Srcの上流および下流のシグナル分子(FGFR3,mTOR,ILKなど)であることから、c-SrcがmiRNAを介して自らのシグナル伝達経路をチューニングすることによって、がん化形質の発現をポジティブにコントロールするという新しい制御システムの存在を明らかにした(図2)。現在、c−Src活性化によるmiRNA発現の制御機構の解析を進めている。
III. 後期エンドソーム/リソソームを介する増殖シグナルの解析
c-Srcの標的分子探索の過程で、後期エンドソーム/リソソームに特異的に局在する新たな膜アダプター蛋白質p18を同定し、その機能解析を進めている。これまでに、p18がp14/MP1と複合体を形成することによって、mTORC1が後期エンドソーム/リソソーム上で活性化するために必須となる足場として機能することを明らかにした。また、p18KOマウスがリソソームの成熟に重篤な異常を示して胎生致死となることから、リソソーム成熟過程におけるp18の役割が注目され、その際に機能するp18-mTORC1経路の標的分子の同定と機能解析を進めている(図3)。さらに、p18-mTORC1経路が、細胞の増殖や成長、及びSrcなどのがん遺伝子を介するがん化においても必須の役割を担うことから、その増殖シグナル経路における機能についても分子レベルでの解析を進めている。
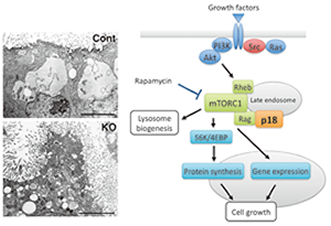 |
図3. 新たな後期エンドソーム膜アダプター蛋白質p18の機能 |