当研究室では、C型肝炎ウイルス(HCV)の細胞への侵入、翻訳、複製、出芽、そして発症病理の分子機序の解析と、遺伝子治療に必須な新しい遺伝子導入ベクターの開発を進めている。
1.HCVの分子生物学
HCVの感染者は世界で1億3千万人も存在し、その多くが慢性持続感染へと移行し、肝硬変を経て肝細胞癌を発症する。近年、有効なHCVの分子標的薬が開発され、C型慢性肝炎治療は大きく進歩した。しかしながら、既に肝硬変を発症している患者や、副作用を伴う薬剤投与に耐えられない高齢者に対する治療法はなく、また、ウイルスを排除できたとしても、肝発癌の危惧を完全に払拭できる訳ではない。さらに、薬剤耐性ウイルスの出現も大きな問題となっている。ウイルス蛋白質よりも、HCVの複製に重要な宿主因子を標的とした抗ウイルス剤の方が、薬剤耐性ウイルスの出現頻度は圧倒的に低い。そこで、我々はHCVの増殖や病原性発現に関与する宿主因子を解析し、C型慢性肝炎の新しい創薬ターゲットを検索している。細胞に侵入したHCVのゲノムRNAから翻訳された前駆体蛋白質は、細胞のシグナルペプチダーゼとシグナルペプチドペプチダーゼ、そして、ウイルスがコードしているプロテアーゼによって、10個の蛋白質に切断される。ほとんどのRNAウイルスは細胞質で複製するが、成熟したHCVコア蛋白質の一部は核へ移行し、核内プロテアソームの活性化因子であるPA28γと相互作用して分解される。HCVのコア蛋白質を発現するトランスジェニックマウスは、C型慢性肝炎患者で観察される、インスリン抵抗性、脂肪肝、そして肝細胞癌を発症するが、このマウスからPA28γを欠損させると、これらの病態が完全に消失する。また、PA28γの発現を抑制すると、ウイルス粒子の産生が低下することから、コア蛋白質の一部がPA28γ依存的に核内で分解されることが、HCVの粒子産生だけでなく、病原性発現にも深く関与していることが明らかになった。さらに、FKBP8やhBind-1等のコシャペロンがNS5A蛋白質と相互作用することによって、分子シャペロンであるHsp90を複製複合体へリクルートすることが、HCVの複製に重要であることを明らかにした。また、HCVの組織特異性を決定する宿主因子として、肝臓特異的に発現しているmiR-122やVLDL (Very Low-Density Lipoprotein)関連因子の重要性が報告されているが、その詳細は不明な点が多い。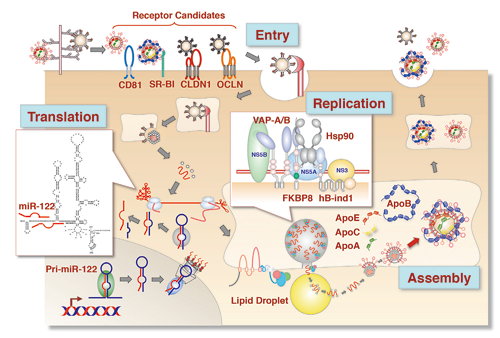 そこで、HCVの粒子産生に関与する、VLDL関連因子のアポリポ蛋白質B (ApoB)とApoEを同時に欠損させた細胞株を樹立したところ、粒子産生は約1/100に減少した。興味深いことに、ApoB/ApoE欠損細胞株にApoA1, ApoA2, ApoC1, ApoC2, あるいは、ApoC3を発現させると粒子産生が回復することから、種々のアポリポ蛋白質が相互に補完しながら、HCVの感染性粒子産生に関与していることが明らかとなった。HCV研究の最大の障害は、患者血清中のHCVを培養できる細胞培養系や感受性を示す小型実験動物を欠くことである。HCVのモデルウイルスとして、同じフラビウイルス属の日本脳炎ウイルスの研究も進めている。
そこで、HCVの粒子産生に関与する、VLDL関連因子のアポリポ蛋白質B (ApoB)とApoEを同時に欠損させた細胞株を樹立したところ、粒子産生は約1/100に減少した。興味深いことに、ApoB/ApoE欠損細胞株にApoA1, ApoA2, ApoC1, ApoC2, あるいは、ApoC3を発現させると粒子産生が回復することから、種々のアポリポ蛋白質が相互に補完しながら、HCVの感染性粒子産生に関与していることが明らかとなった。HCV研究の最大の障害は、患者血清中のHCVを培養できる細胞培養系や感受性を示す小型実験動物を欠くことである。HCVのモデルウイルスとして、同じフラビウイルス属の日本脳炎ウイルスの研究も進めている。
2.バキュロウイルスベクターの開発
HCVのように培養細胞で複製できないウイルス感染症の研究には、ウイルスベクターが重要な武器となる。また、先端医療の要となる遺伝子治療には、安全で遺伝子導入効率が高い、遺伝子導入ベクターの開発が不可欠である。我々は昆虫ウイルスであるバキュロウイルスAutographa californica nucleopolyhedrovirus (AcNPV)を利用した多機能ウイルスベクター開発を進めている。AcNPVは134kbpの環状2本鎖DNAをゲノムとして持ち、感染細胞の30~40%が多角体蛋白質に置き換わるほどの強力な多角体プロモーターを有している。この性質を利用して、AcNPVは昆虫細胞を用いた組換え蛋白質の産生系として利用されている。また、AcNPVは昆虫細胞のみならず、広範な哺乳動物細胞に、効率よく外来遺伝子を導入できることが判明し、新しい遺伝子導入ベクターとしても注目されている。AcNPVは大きな外来遺伝子を組み込むことができ、しかも、哺乳動物細胞では全く複製しないことから、アデノウイルスベクター等で問題となる自立増殖ウイルスの出現や、ウイルス蛋白質の発現による有害な免疫応答の誘導等の危惧がない。また、細胞内に取り込まれたAcNPVゲノムは、TLR9依存的に炎症性サイトカインを、またTLR9非依存的にインターフェロン (IFN)を誘導し、AcNPVをマウスの鼻腔内に投与すると、致死性のインフルエンザウイルスの感染から防御されることを明らかにした。さらに、AcNPVゲノムによるIFNの誘導には、STING/TBK1/IRF3経路が重要な役割を演じていることを明らかにした。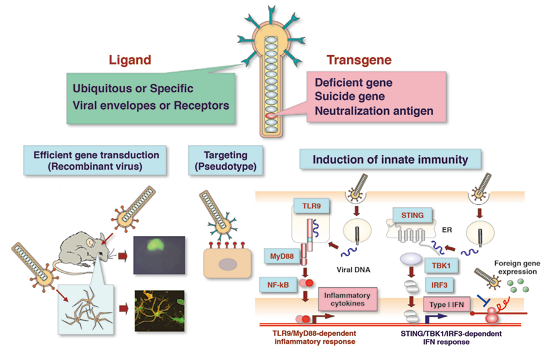 ウイルス感染によって自然免疫の誘導が抑制された細胞では、AcNPVによる外来遺伝子の発現が亢進することから、感染細胞特異的に外来遺伝子を発現できる可能性が示された。以上の成績から、AcNPVは昆虫細胞での組換え蛋白質の大量発現ベクターや哺乳動物細胞への遺伝子導入ベクターはもとより、ワクチンベクターやターゲッティングベクターとしての可能性が示唆された。
ウイルス感染によって自然免疫の誘導が抑制された細胞では、AcNPVによる外来遺伝子の発現が亢進することから、感染細胞特異的に外来遺伝子を発現できる可能性が示された。以上の成績から、AcNPVは昆虫細胞での組換え蛋白質の大量発現ベクターや哺乳動物細胞への遺伝子導入ベクターはもとより、ワクチンベクターやターゲッティングベクターとしての可能性が示唆された。