当研究分野では、生体防御機構が関与する様々な生物学的、医学的問題を取り扱っている。とくに、GPIアンカー型タンパク質の生合成経路・輸送経路・切断遊離機構の研究、それらの異常による疾患の発症機序に関する研究、ゴルジ体のpH調節のメカニズムと生理的意義に関する研究、近接したオルガネラ膜間の脂質やイオンの輸送を司る「膜接触部位」の構成因子の同定と機能解析に関する研究を行っている。
1)GPIアンカー型タンパク質の生合成・輸送・リモデリング機構の研究
GPIアンカーは、ホスファチジルイノシトールに糖鎖がつながった糖脂質で、タンパク質のC末端に結合して膜アンカーとして働く。哺乳動物では150種程度のGPIアンカー型タンパク質が知られており、生体防御や細胞間の情報伝達に重要なものが多く含まれるほか、ウイルスや毒素の受容体になっているものもある。GPIアンカーの特徴は、タンパク質を脂質マイクロドメインに局在させること、アンカー部分の切断によって膜から遊離し得ること、アピカル側へ輸送させることなどである。我々は、GPIアンカーの生合成に働くPIG(PhosphatidylInositol Glycan)遺伝子群と、GPIアンカーがタンパク質に付加された後の過程に働く PGAP(Post GPI-Attachment to Proteins)遺伝子群の同定と機能解明に包括的に取り組んでいる(図1)。これらの研究により、多くのタンパク質がGPIによって膜にアンカーされていることの生物学的意義を明らかにしたいと考えている。
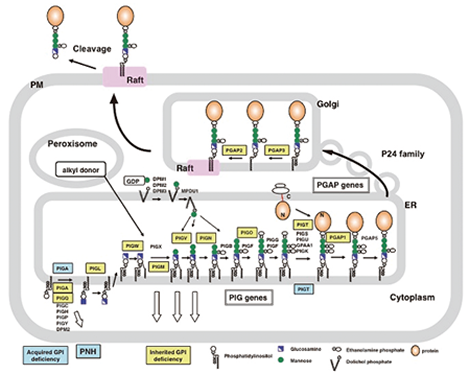
図1: GPIアンカー型タンパク質の生合成・輸送・切断遊離
GPIアンカー型タンパク質は、PIG遺伝子群の働きで生合成されたGPIがタンパク質に付加されてできる。その後、GPIアンカー型タンパク質は、p24ファミリー蛋白質が関与する分泌経路によって小胞体からゴルジ体を経て細胞表面へ輸送される。その過程で、PGAP遺伝子群の働きにより、GPIアンカーの糖鎖と脂質のそれぞれがリモデリングを受け、成熟型のGPIアンカー型タンパク質になる。一部のGPIアンカー型タンパク質は、切断酵素の働きで細胞表面から遊離する。現在までに報告されている先天性GPI欠損症の責任遺伝子を黄色、後天性GPI欠損症であるPNHの責任遺伝子を水色で示す。
2)GPI欠損症の発症機序に関する研究
我々は英国のクループとの共同研究によりGPI生合成に必須の遺伝子、PIGMの異常による先天性GPI欠損症(Inherited GPI deficiency, IGD)を世界で始めて報告したが、その後次世代シークエンサーを使った解析により現在までにGPI 関連遺伝子を責任遺伝子とする12種のIGDが見つかり、新たな疾患単位として国内外で共同研究が広がっている (図1)。GPIの完全欠損は胎生致死になるのでPIG遺伝子群が原因の場合は部分欠損症であり、GPIリモデリングに関わる遺伝子の場合にはnull変異もある。責任遺伝子の種類と欠損の程度により多彩な症状を示す。てんかん、運動精神発達の障害を主症状とし、時に顔貌、手指の異常、多臓器の奇形、高アルカリホスファターゼ血症を伴う。Mabry syndromeとCHIME syndromeの主要な責任遺伝子であり、Ohtahara syndrome、West syndromeなど早期発症てんかん性脳症の一部にIGDが存在することが判明している。高アルカリホスファターゼ血症とフローサイトメトリー検査により好中球のCD16の発現低下を指標にすることが診断に有効であることが明らかになり、今後症例を集積して診断基準を制定しさらには治療法の解明をめざしている。一方後天性GPI欠損症である発作性夜間血色素尿症(PNH)はGPIアンカー型タンパク質である補体制御因子が欠損しているために、赤血球が補体により破壊されて、溶血性貧血をきたす血液疾患である。後天的に造血幹細胞でX染色体遺伝子のPIGAに突然変異がおこりGPI欠損細胞となった後、併発する造血幹細胞への自己免疫的機序から逃れてGPI欠損クローンが増大し、さらに良性腫瘍性増殖を来す遺伝子変異が起こることにより病態が完成すると考えており、発症機序を明らかにすることを目指している。最近、PIGAの突然変異ではなく常染色体遺伝子PIGTの1つのアリルの遺伝性変異に加えてもう一方のアリルの体細胞突然変異によるPNHが見つかっている。
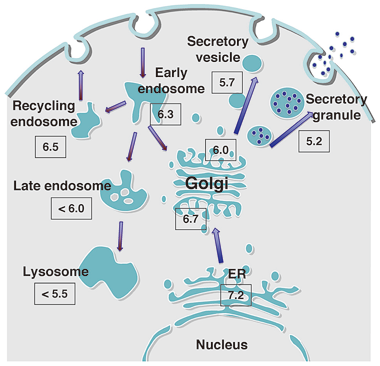 |
図3:細胞内オルガネラのpH調節 |
3)細胞内酸性オルガネラのpH調節機構ならびに膜接触部位の構成因子・機能解析
細胞内オルガネラは脂質二重膜によってお互いに隔離されている画分であり、その機能を最大限に発揮するために固有の環境やタンパク質・脂質成分を保持している。その重要な環境因子の一つがpHである。分泌経路やエンドサイトーシス経路のオルガネラの内腔は固有の酸性pHに保たれていて、その異常で細胞レベルでは、タンパク質・脂質の輸送・プロセッシング・糖鎖修飾障害やオルガネラの形態異常が、また個体レベルでは様々な疾患が発症することが知られている。その重要性にも拘らずそれらの異常フェノタイプの起こるメカニズムについてはほとんど判っていない。当グループは、ゴルジ装置のpH異常を示す変異細胞株を初めて樹立し、その責任タンパク質の同定・機能解析を報告した。今後、これらの変異細胞・遺伝子の利用並びに新たなpH異常を示す変異細胞株の樹立解析を通じて、細胞内オルガネラのpHの調節機構やその生理的意義についてより理解を深め、pH異常が病因である疾患に対する新たな創薬の開発への突破口となることを目的としている。また、この研究から派生したテーマとして、異なったオルガネラ膜が近接して脂質やイオンを輸送する場として近年注目されている「膜接触部位」の構成因子の同定・可視化による動態解析およびその機能解析にも力を入れている。