ヒトやマウスのゲノムプロジェクトが一応の完了を迎えた現在では、人工的に遺伝子を操作した遺伝子組換え動物が、疾病の研究や基礎的な生物学研究に重要な役割を果たしつつある。我々は生体レベルでの遺伝子機能解析ツールを開発して生殖生物学分野での研究を行うとともに、遺伝子組換え動物の作製支援を行っている。
我々は世界に先駆けてオワンクラゲのGFP遺伝子を組み込んだグリーンマウスを作製するとともに、そのノウハウを生かして受精のメカニズムや生殖細胞の成り立ちを研究している(図1~3)。これまでに精巣特異的な小胞体シャペロン群(CLGN, CALR3, PDILT)のノックアウト(KO)マウスを作製し、それらが精子膜タンパク質(ADAM3)の品質管理に必須であること、ADAM3を失ったKO精子は子宮から卵管に移行できずに雄性不妊になることを明らかにしてきた(図2, #5)。最近ではGPIアンカータンパク質であるTEX101がADAM3の存在に必須であることを明らかにした(#3)。また、我々が以前同定した精子側の融合因子であるIZUMO1(Nature, 2005)に蛍光タンパク質を付加したトランスジェニック(Tg)マウス精子のライブイメージング観察により、受精(精子-卵子の融合)の瞬間の観察に成功した(図3, #4)。
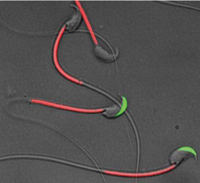
図1)頭部の先体がGFP、尾部のミトコントリアがRFPでラベルされたトランスジェニックマウス精子の写真。先体反応により先体内のGFPを放出することで、精子は受精可能になる。 |
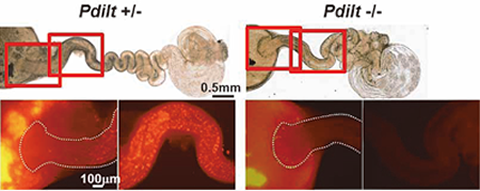
図2)ADAM3が消失したPdiltノックアウトマウス精子は子宮から 卵管へ移行できず、雄性不妊の原因となる。 |
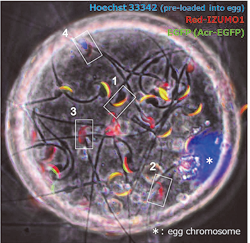
図3)卵細胞膜上に結合したRed-IZUMO1トランスジェニックマウス精子の写真。先体反応によりGFPを消失した精子(2, 3)はIZUMO1(赤色蛍光)の局在が変化する。卵子と融合した精子の核は青色蛍光を呈し(4)、融合直後の精子の蛍光消失が、融合の特異点を示している。 |
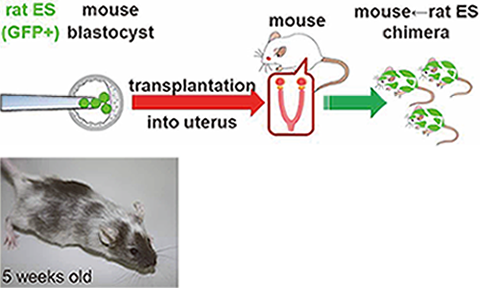
図4)我々が樹立したGFP蛍光を持つラットES細胞をマウス 胚盤胞へ注入して作製したマウスとラットのキメラ動物。毛色の白い部分がマウス、有色部分がラット由来の細胞で構成され ている。 |
この他にも、我々は発生工学を駆使したアプローチから生命の根源に迫るチャレンジングな研究を目指している。レンチウイルスベクターを用いることで胎盤にのみ遺伝子操作できる方法を考案し(Nat Biotechnol, 2007)、胎盤特異的にsFLT1を発現することで妊娠高血圧症候群のモデルマウスの開発にも成功した(PNAS, 2011)。また、独自に樹立したラットES細胞を用いてマウス↔ラットキメラ動物を用いた臓器再生医学研究や (図4, Genes Cells, 2011)、miRNA欠損マウスを用いたnon coding RNAの生体機能解析などに取り組んでいる(#2)。最近では、新たな遺伝子改変技術として注目を集めているCRISPR/Casシステムを用いて、遺伝子改変マウス・ラットの作製に成功した(#1)。今後も、遺伝子組換え動物作製の効率化を目指して開発・研究を進めていく。
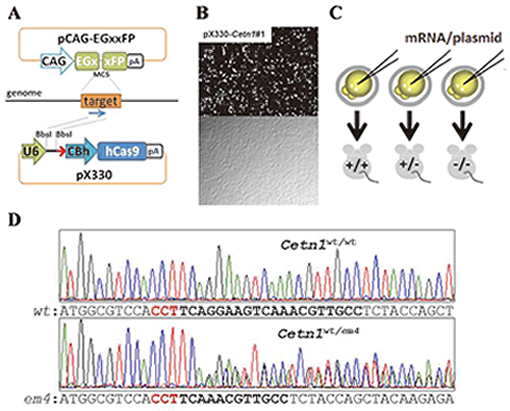
図5)
A. ヌクレアーゼ活性の高いgRNA配列を簡便に調べるために、GFPを指標にした培養細胞検定系を構築した。
B. pCAG-EGxxFPにCetn1遺伝子領域を挿入したプラスミドに加え、gRNAとCas9ヌクレアーゼを同時に発現するpX330をHEK293T細胞へ遺伝子導入後48時間の蛍光写真(上:GFP、下:明視野)。
C. GFP蛍光が観察できたpX330-Cetn1#1プラスミドを環状のまま、マウス受精卵へ注入して、Cetn1遺伝子欠損マウスを作製した。
D. CRISPR/Cas9の特徴として、PAM配列(赤字)より3塩基上流でDNA二本鎖切断を起こす。その結果、8塩基欠失の変異マウスが得られた。
(WT; 野生型、em4; 変異型)
研究支援
学内のみならず広く学外にも遺伝子組換え動物の作製支援を、感染動物実験施設と共同で行っている。これまでにトランスジェニックマウス、ノックアウトマウスはそれぞれ400ラインを超える作製実績がある (http://www.tgko.biken.osaka-u.ac.jp/tgko/sum/index)。さらに遺伝子組換え動物を重要な研究資源として保存する目的で、1000ライン以上の受精卵や精子の凍結保存も支援実績を有している。