研究グループ
| 教授(兼) | 審良 静男 |
| 准教授 | 前田 和彦 |
| 助教 | 佐藤 荘 |
| 特任助教(兼) | 熊谷 雄太郎 |
| 特任助教(兼) | 丸山 健太 |
研究室ホームページ
研究内容
我々は、進化的に保存された病原体に対する防御機構である自然免疫について研究を行っている。自然免疫の誘導にはパターン認識受容体が重要な役割を果たす。パターン認識受容体は、細菌・真菌・原虫・ウイルスなど幅広い病原体を認識し、サイトカインやインターフェロンなどの炎症性因子の産生を誘導する。一方で、パターン認識受容体は環境汚染物質や自己代謝物質に誤って反応し、炎症性疾患の発症要因ともなる。つまり、自然免疫は我々の身を守る、また我々の身を傷つけるという正負両方の面を持っており、感染症や炎症性疾患など様々な疾患の発症に深く関わっている。この自然免疫に関する理解を深めるため、我々はパターン認識受容体を介した自然免疫応答の制御機構の解明と自然免疫担当細胞の新たな機能の探索を行っている。
1.微小管依存的なNLRP3インフラマソームの活性化
自然免疫に関わるパターン認識受容体であるNLRP3は、情報伝達因子ASCやプロテアーゼCaspase-1と共にNLRP3インフラマソームを形成し、炎症性サイトカインIL-1βの産生を介して炎症を惹起する。尿酸結晶などの刺激性粒子によるNLRP3インフラマソームの過剰な活性化は痛風などの炎症性疾患の発症要因となるため、NLRP3インフラマソーム活性化を阻害する化合物の同定は重要な研究課題である。我々は、化合物ライブラリーを用いたスクリーニングを行い、痛風治療薬であるコルヒチンがNLRP3インフラマソームの活性化を抑制することを見出した(Misawa T et al., Nat Immunol, 2013)。微小管は尿酸結晶などの刺激に応じてミトコンドリアを微小管形成中心方向へと輸送することにより、小胞体上のNLRP3とミトコンドリア上のASCの近接を誘導し、NLRP3インフラマソームの活性化を促進する。コルヒチンなどのチューブリン重合阻害剤は、微小管依存的に誘導される小胞体とミトコンドリアの近接を介したNLRP3インフラマソームの活性化を抑制する。
自然免疫に関わるパターン認識受容体であるNLRP3は、情報伝達因子ASCやプロテアーゼCaspase-1と共にNLRP3インフラマソームを形成し、炎症性サイトカインIL-1βの産生を介して炎症を惹起する。尿酸結晶などの刺激性粒子によるNLRP3インフラマソームの過剰な活性化は痛風などの炎症性疾患の発症要因となるため、NLRP3インフラマソーム活性化を阻害する化合物の同定は重要な研究課題である。我々は、化合物ライブラリーを用いたスクリーニングを行い、痛風治療薬であるコルヒチンがNLRP3インフラマソームの活性化を抑制することを見出した(Misawa T et al., Nat Immunol, 2013)。微小管は尿酸結晶などの刺激に応じてミトコンドリアを微小管形成中心方向へと輸送することにより、小胞体上のNLRP3とミトコンドリア上のASCの近接を誘導し、NLRP3インフラマソームの活性化を促進する。コルヒチンなどのチューブリン重合阻害剤は、微小管依存的に誘導される小胞体とミトコンドリアの近接を介したNLRP3インフラマソームの活性化を抑制する。
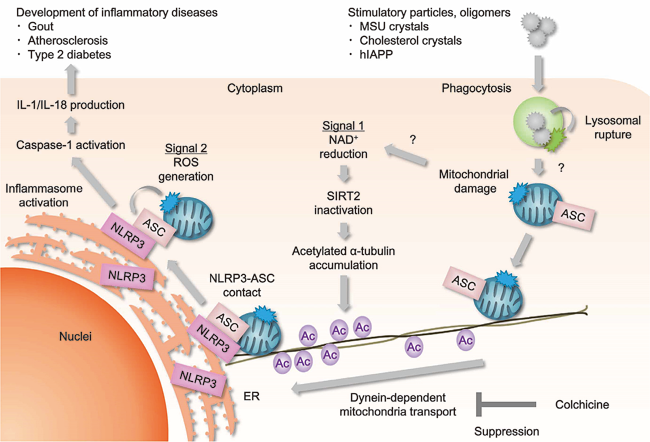
図1. NLRP3インフラマソームの活性化
尿酸結晶などの刺激性粒子は、ミトコンドリアの損傷を引き起こすため、細胞内NAD+が減少してNAD+依存性のαチューブリン脱アセチル化酵素であるSIRT2の活性が低下する。SIRT2の活性低下はアセチル化αチューブリンを増加させるため、ダイニン依存的なミトコンドリアの輸送を介したNLRP3とASCの近接が誘導される。損傷ミトコンドリア由来の活性酸素種は、NLRP3インフラマソームの直接的な活性化を誘導するが、NLRP3とASCの近接には影響を与えない。これらの解析から、NLRP3を活性酸素種が直接的に活性化する経路に加えて、NLRP3からASCへの情報伝達を行うための場を整える微小管依存的な経路がNLRP3インフラマソームの活性化に関わることが明らかとなった。(図1)
2.合成2本鎖RNAが有する免疫制御作用におけるカテプシンDの関与
自然免疫担当細胞の一つ樹状細胞は、パターン認識受容体を介してサイトカイン産生や共刺激分子発現を誘導し、最終的にT細胞の活性化や抗体産生といった獲得免疫を成立させるいわば自然免疫と獲得免疫の橋渡しの役割を果たす細胞である。我々は、ウイルスRNAを模倣する合成2本鎖RNA(dsRNA)であるPoly ICによる樹状細胞の活性化に関する解析を行い、Poly ICにより誘導される一部の樹状細胞の細胞死が、周囲の樹状細胞の活性化に深く関与することを見出した(Zou J et al., Immunity, 2013)。樹状細胞においては、dsRNAを認識するRIG-I-like receptorsおよびアダプター因子IPS-1を介したシグナル伝達経路が自然免疫応答の誘導に重要な役割を果たす。Cathepsin D は本来リソソーム内に局在する分解酵素であるが、Poly I:Cを取り込んだ樹状細胞においてはリソソームの膜が損傷するために、Cathepsin Dがリソソームから漏出する。細胞質に流入したCathepsin D は、IPS-1と結合することにより、Poly ICにより誘導される自然免疫応答を促進する。また、Cathepsin Dは細胞死を誘導することで、核酸結合因子の一つHMGB1の放出を促す。
自然免疫担当細胞の一つ樹状細胞は、パターン認識受容体を介してサイトカイン産生や共刺激分子発現を誘導し、最終的にT細胞の活性化や抗体産生といった獲得免疫を成立させるいわば自然免疫と獲得免疫の橋渡しの役割を果たす細胞である。我々は、ウイルスRNAを模倣する合成2本鎖RNA(dsRNA)であるPoly ICによる樹状細胞の活性化に関する解析を行い、Poly ICにより誘導される一部の樹状細胞の細胞死が、周囲の樹状細胞の活性化に深く関与することを見出した(Zou J et al., Immunity, 2013)。樹状細胞においては、dsRNAを認識するRIG-I-like receptorsおよびアダプター因子IPS-1を介したシグナル伝達経路が自然免疫応答の誘導に重要な役割を果たす。Cathepsin D は本来リソソーム内に局在する分解酵素であるが、Poly I:Cを取り込んだ樹状細胞においてはリソソームの膜が損傷するために、Cathepsin Dがリソソームから漏出する。細胞質に流入したCathepsin D は、IPS-1と結合することにより、Poly ICにより誘導される自然免疫応答を促進する。また、Cathepsin Dは細胞死を誘導することで、核酸結合因子の一つHMGB1の放出を促す。
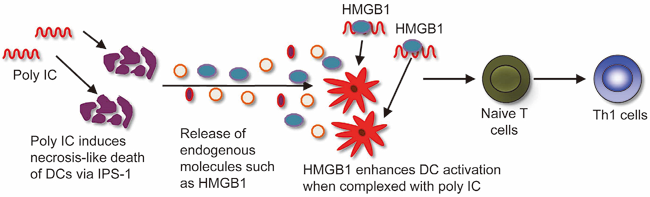
図2. Poly ICによる樹状細胞の活性化
死細胞から放出されたHMGB1とPoly ICは複合体を形成し、効率よく周囲の樹状細胞に取り込まれることで、自然免疫応答をさらに活性化する。Poly ICは、樹状細胞においてこのポジティブループを誘導することにより獲得免疫の活性化を強く促進するため、強力なワクチンアジュバントとして働く。(図2)
3.脂肪組織の維持に関わるマクロファージの新たな役割
マクロファージは、M1とM2という少なくとも2つのグループから構成されている。M1マクロファージは炎症応答を惹起し、細菌やウイルス感染に対する宿主防御において中心的な役割を担っている。一方で、M2マクロファージは抗炎症応答や組織再生などに関与すると考えられている。我々は、M2マクロファージの一種である組織常在型マクロファージ(M2様マクロファージと名付けた)の分化に必須の遺伝子として、Trib1を同定した(Satoh T et al., Nature, 2013)。ヒトのゲノムワイド関連解析から脂質代謝に関わることが示唆されているTrib1は、ユビキチンリガーゼであるCOP1と相互作用することによってタンパク質分解に関与する分子である。血液系の細胞においてTrib1を欠損したマウス(Trib1欠損キメラマウス)では、骨髄、脾臓、肺および脂肪組織といった様々な抹消組織でM2様マクロファージが著しく減少する。この組織常在性のM2様マクロファージの減少は、Trib1欠損に起因する転写因子C/EBPαの過剰蓄積により引き起こされる。Trib1欠損キメラマウスは、通常の食事を与えて飼育している環境化において、脂肪分解が亢進して脂肪細胞自体の大きさが萎縮する。
マクロファージは、M1とM2という少なくとも2つのグループから構成されている。M1マクロファージは炎症応答を惹起し、細菌やウイルス感染に対する宿主防御において中心的な役割を担っている。一方で、M2マクロファージは抗炎症応答や組織再生などに関与すると考えられている。我々は、M2マクロファージの一種である組織常在型マクロファージ(M2様マクロファージと名付けた)の分化に必須の遺伝子として、Trib1を同定した(Satoh T et al., Nature, 2013)。ヒトのゲノムワイド関連解析から脂質代謝に関わることが示唆されているTrib1は、ユビキチンリガーゼであるCOP1と相互作用することによってタンパク質分解に関与する分子である。血液系の細胞においてTrib1を欠損したマウス(Trib1欠損キメラマウス)では、骨髄、脾臓、肺および脂肪組織といった様々な抹消組織でM2様マクロファージが著しく減少する。この組織常在性のM2様マクロファージの減少は、Trib1欠損に起因する転写因子C/EBPαの過剰蓄積により引き起こされる。Trib1欠損キメラマウスは、通常の食事を与えて飼育している環境化において、脂肪分解が亢進して脂肪細胞自体の大きさが萎縮する。
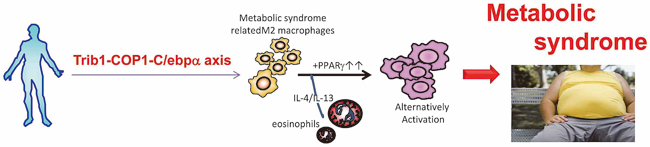
図3. M2様マクロファージの役割
重要なことに、この変異マウスに野生型マウスより調整したM2様マクロファージを移植するとこの病態が回復する。また、高脂肪食を与えて飼育したTrib1欠損キメラマウスは、高トリグリセリド血症やインスリン抵抗性などのメタボリックシンドロームの病態を発症した。これらの解析から、Trib1およびC/EBPαにより分化が制御されている組織常在型M2様マクロファージが脂肪組織の維持とメタボリックシンドロームの抑制に深く関わることが明らかとなった。(図3)
自然免疫の包括的理解と免疫関連疾患の治療法開発というゴールを目指して、今後は研究をさらに発展させていきたい。
最近の代表的な論文
- Uehata T, Iwasaki H, Vandenbon A, Matsushita K, Hernandez-Cuellar E, Kuniyoshi K, Satoh T, Mino T, Suzuki Y, Standley DM, Tsujimura T, Rakugi H, Isaka Y, Takeuchi O, Akira S. Malt1-induced cleavage of regnase-1 in CD4(+) helper T cells regulates immune activation. Cell. 2013 May 23;153(5):1036-49.
- Misawa T, Takahama M, Kozaki T, Lee H, Zou J, Saitoh T, Akira S. Microtubule-driven spatial arrangement of mitochondria promotes activation of the NLRP3 inflammasome. Nat Immunol. 2013 May;14(5):454-60.
- Zou J, Kawai T, Tsuchida T, Kozaki T, Tanaka H, Shin KS, Kumar H, Akira S. Poly IC triggers a cathepsin D- and IPS-1-dependent pathway to enhance cytokine production and mediate dendritic cell necroptosis. Immunity. 2013 Apr 18;38(4):717-28.
- Satoh T, Kidoya H, Naito H, Yamamoto M, Takemura N, Nakagawa K, Yoshioka Y, Morii E, Takakura N, Takeuchi O, Akira S. Critical role of Trib1 in differentiation of tissue-resident M2-like macrophages. Nature. 2013 Mar 28;495(7442):524-8.
- Maruyama K, Fukasaka M, Vandenbon A, Saitoh T, Kawasaki T, Kondo T, Yokoyama KK, Kidoya H, Takakura N, Standley D, Takeuchi O, Akira S. The transcription factor Jdp2 controls bone homeostasis and antibacterial immunity by regulating osteoclast and neutrophil differentiation. Immunity. 2012 Dec 14;37(6):1024-36.